Ο νόμος του Raoult σε τι συνίσταται, θετικές και αρνητικές αποκλίσεις
Το Ο νόμος του Raoult Προτάθηκε από τη γαλλική χημικός Φρανσουά-Μαρί Ραούλ το 1887, και χρησιμεύει για να εξηγήσει τη συμπεριφορά της πίεσης ατμών ενός διαλύματος δύο (τυπικά ιδανικό) μη αναμίξιμου ουσίες σύμφωνα με την μερική πίεση ατμών της κάθε παρόν συστατικό σε αυτό.
Υπάρχουν νόμοι της χημείας που χρησιμοποιείται για να περιγράψει τη συμπεριφορά των υλικών υπό διαφορετικές συνθήκες και να εξηγήσει τα φαινόμενα που εμπλέκονται, χρησιμοποιώντας επιστημονικά αποδεδειγμένο μαθηματικά μοντέλα. Ο νόμος του Raoult είναι ένας από αυτούς.

Χρησιμοποιώντας μια εξήγηση βασίζεται στις αλληλεπιδράσεις μεταξύ των μορίων του αερίου (ή υγρό) για να προβλέψει τη συμπεριφορά των πιέσεων ατμών, ο νόμος αυτός χρησιμοποιήθηκε για τη μελέτη μη-ιδανικές ή πραγματικές λύσεις, όποτε κρίνεται απαραίτητο συντελεστών για τη διόρθωση του μοντέλου μαθηματικό και προσαρμόζεται σε μη ιδανικές συνθήκες.
Ευρετήριο
- 1 Από τι συνίσταται;?
- 2 Θετικές και αρνητικές αποκλίσεις
- 2.1 Θετικές αποκλίσεις
- 2.2 Αρνητικές αποκλίσεις
- 3 Παραδείγματα
- 3.1 Βασικό μείγμα
- 3.2 Δυαδικό μίγμα με μη πτητική διαλυμένη ουσία
- 4 Αναφορές
Από τι συνίσταται;?
του νόμου Ραούλ βασίζεται στην υπόθεση ότι οι λύσεις που εμπλέκονται συμπεριφέρεται ιδανικά: αυτό οφείλεται στο γεγονός ότι ο νόμος αυτός βασίζεται στην ιδέα ότι οι διαμοριακές δυνάμεις μεταξύ διαφορετικών μορίων είναι οι ίδιες με εκείνες μεταξύ παρόμοιων μορίων (που δεν είναι τόσο επιτυχής στην πραγματικότητα).
Στην πραγματικότητα, όσο πιο κοντά η λύση είναι η ιδανική, τόσο περισσότερες ευκαιρίες θα πρέπει να συμμορφώνονται με τα χαρακτηριστικά που προτείνει ο νόμος αυτός..
Αυτός ο νόμος αφορά την πίεση ατμών ενός διαλύματος με ένα μη-πτητικό διαλυμένης ουσίας, δηλώνοντας ότι αυτό θα είναι ίση με την τάση ατμών του καθαρού διαλυμένης ουσίας στη θερμοκρασία αυτή πολλαπλασιάζεται με το γραμμομοριακό κλάσμα αυτής. Αυτό εκφράζεται με μαθηματικούς όρους για ένα μόνο συστατικό με τον ακόλουθο τρόπο:
Pi = Pºi . Χi
Σε αυτή την έκφραση Pi είναι ίση με τη μερική τάση ατμών του συστατικού ί στο μείγμα αερίων, Pºi είναι η τάση ατμών του καθαρού συστατικού i και Χi είναι το γραμμομοριακό κλάσμα του συστατικού ί στο μείγμα.
Ομοίως, όταν διάφορα συστατικά είναι σε διάλυμα και αυτά έχουν καταλήξει σε κατάσταση ισορροπίας, μπορεί να υπολογίσει το συνολικό τάση ατμών του διαλύματος με συνδυασμό του Raoult με Dalton:
P = PºΑΧΑ + PºΒΧΒ + PºΓΧγ...
Επίσης, σε εκείνες τις λύσεις όπου υπάρχει μόνο μία διαλελυμένη ουσία και ο διαλύτης, ο νόμος μπορεί να διαμορφωθεί όπως φαίνεται κατωτέρω:
PΑ = (1-ΧΒ) x PºΑ
Θετικές και αρνητικές αποκλίσεις
Οι λύσεις που μπορούν να μελετηθούν με αυτόν τον νόμο θα πρέπει κανονικά να συμπεριφέρονται ιδανικά, καθώς οι αλληλεπιδράσεις μεταξύ των μορίων τους είναι μικρές και επιτρέπουν να λαμβάνονται οι ίδιες ιδιότητες σε όλη τη λύση χωρίς εξαίρεση..
Ωστόσο, οι ιδανικές λύσεις είναι ουσιαστικά ανύπαρκτες στην πραγματικότητα, οπότε δύο συντελεστές πρέπει να ενσωματωθούν στους υπολογισμούς που αντιπροσωπεύουν τις διαμοριακές αλληλεπιδράσεις. Αυτός είναι ο συντελεστής αστοχίας και ο συντελεστής δραστηριότητας.
Με αυτή την έννοια, οι αποκλίσεις σε σχέση με τον νόμο του Raoult ορίζονται ως θετικές ή αρνητικές, ανάλογα με τα αποτελέσματα που ελήφθησαν τότε.
Θετικές αποκλίσεις
Θετικές αποκλίσεις σε σχέση με το νόμο του Raoult συμβαίνουν όταν η τάση ατμών της λύσης είναι μεγαλύτερη από ό, τι υπολογίστηκε με το νόμο του Raoult.
Αυτό συμβαίνει όταν οι δυνάμεις συνοχής μεταξύ παρόμοιων μορίων είναι μεγαλύτερες από τις ίδιες δυνάμεις μεταξύ διαφορετικών μορίων. Στην περίπτωση αυτή, και τα δύο συστατικά εξατμίζονται πιο εύκολα.
Αυτή η απόκλιση φαίνεται στην καμπύλη τάσης ατμών ως μέγιστο σημείο σε μια συγκεκριμένη σύνθεση, σχηματίζοντας θετικό αζεότροπο.
Το αζεότροπο είναι ένα υγρό μείγμα δύο ή περισσοτέρων χημικών ενώσεων που συμπεριφέρονται σαν να σχηματίστηκαν από ένα μόνο συστατικό και που εξατμίζονται χωρίς αλλαγή της σύνθεσης.
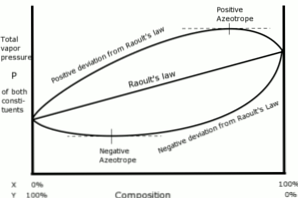
Αρνητικές αποκλίσεις
Αρνητικές αποκλίσεις από το νόμο του Raoult συμβαίνουν όταν η τάση ατμών του μείγματος είναι χαμηλότερη από την αναμενόμενη μετά τον υπολογισμό με το νόμο.
Αυτές οι αποκλίσεις εμφανίζονται όταν οι δυνάμεις συνοχής μεταξύ των μορίων του μίγματος είναι μεγαλύτερες από το μέσο όρο των δυνάμεων μεταξύ των σωματιδίων των υγρών στην καθαρή τους κατάσταση.
Αυτό το είδος της απόκλισης δημιουργεί ένα συγκρατήσεως κάθε συστατικό σε υγρή κατάσταση του από ελκτικές δυνάμεις μεγαλύτερες από εκείνες της ουσίας σε καθαρή κατάσταση, έτσι ώστε η μερική πίεση ατμών του συστήματος μειώνεται.
Τα αρνητικά αζεοτροπικά στις καμπύλες πίεσης ατμών αντιπροσωπεύουν ένα ελάχιστο σημείο και επιδεικνύουν συγγένεια μεταξύ των δύο ή περισσοτέρων συστατικών που εμπλέκονται στο μίγμα.
Παραδείγματα
Τον νόμο του Raoult χρησιμοποιείται συνήθως για τον υπολογισμό της πίεσης ενός διαλύματος με βάση την διαμοριακές δυνάμεις τους, συγκρίνοντας τις υπολογιζόμενες τιμές με πραγματικές τιμές να συμπεράνει κατά πόσον υπάρχει οποιαδήποτε απόκλιση και κατά πόσον αυτό θα πρέπει να είναι θετική ή αρνητική. Ακολουθούν δύο παραδείγματα χρήσεων του νόμου του Raoult:
Βασικό μείγμα
Το ακόλουθο μίγμα βουτανίου και προπανίου, αντιπροσωπεύει μία προσέγγιση της τάσης ατμών, και μπορεί να θεωρήσει ότι αμφότερα τα συστατικά βρίσκονται σε ίσες αναλογίες εντός αυτού του (50-50), σε μία θερμοκρασία 40 ° C:
Χπροπάνιο = 0,5
Pºπροπάνιο = 1352,1 kPa
Χβουτάνιο = 0,5
Pºβουτάνιο = 377,6 kPa
Υπολογίζεται με το νόμο του Raoult:
Pμίγμα = (0,5 χ 377,6 kPa) + (0,5 χ 1352,1 kPa)
Έτσι:
Pμίγμα = 864,8 kPa
Διμερές μίγμα με μη πτητική διαλυτή ουσία
Μερικές φορές συμβαίνει ότι η διαλυμένη ουσία του μείγματος είναι μη πτητική, οπότε ο νόμος χρησιμοποιείται για να κατανοήσει τη συμπεριφορά της τάσης ατμών.
Λαμβάνοντας ένα μείγμα νερού και ζάχαρης σε αναλογίες 95% και 5%, αντίστοιχα, και υπό κανονικές συνθήκες θερμοκρασίας:
Χνερό = 0,95
Pºνερό = 2,34 kPa
Χζάχαρη = 0,05
Pºζάχαρη = 0 kPa
Υπολογίζεται με το νόμο του Raoult:
Pμίγμα = (0.95 χ 2.34 kPa) + (0.05 χ 0 kPa)
Έτσι:
Pμίγμα = 2,22 kPa
Είναι προφανές ότι υπήρξε συμπίεση της πίεσης των υδρατμών λόγω των επιδράσεων των διαμοριακών δυνάμεων.
Αναφορές
- Anne Marie Helmenstine, Ρ. (S.f.). Ο ορισμός του νόμου του Raoult. Ανακτήθηκε από thoughtco.com
- ChemGuide. (s.f.). Του νόμου του Raoult και των μη πτητικών διαλυτών. Ανακτήθηκε από το chemguide.co.uk
- LibreTexts. (s.f.). Ο νόμος του Raoult και τα ιδανικά μίγματα υγρών. Ανακτήθηκε από chem.libretexts.org
- Ουδέτερο. (s.f.). Νόμος του Raoult. Ανακτήθηκε από το neutrium.net
- Wikipedia. (s.f.). Νόμος του Raoult. Ανακτήθηκε από en.wikipedia.org


