Ziehl-Neelsen Stain Ίδρυμα, Αντιδραστήρια και Τεχνική
Το Βαφή Ziehl-Neelsen σε μια τεχνική χρωματισμού για τον εντοπισμό ανθεκτικών σε αλκοόλ μικροοργανισμών (AAR). Το όνομα αυτής της μικροβιολογικής διαδικασίας αναφέρεται στους συγγραφείς της: ο βακτηριολόγος Franz Ziehl και ο παθολόγος Friedrich Neelsen.
Αυτή η τεχνική είναι ένας τύπος διαφορικού χρωματισμού, ο οποίος συνεπάγεται τη χρήση διαφορετικών βαφών για να δημιουργηθεί αντίθεση μεταξύ των δομών που θέλετε να παρατηρήσετε, να διαφοροποιήσετε και να προσδιορίσετε αργότερα. Η χρώση Ziehl-Neelsen χρησιμοποιείται για την αναγνώριση ορισμένων τύπων μικροοργανισμών.
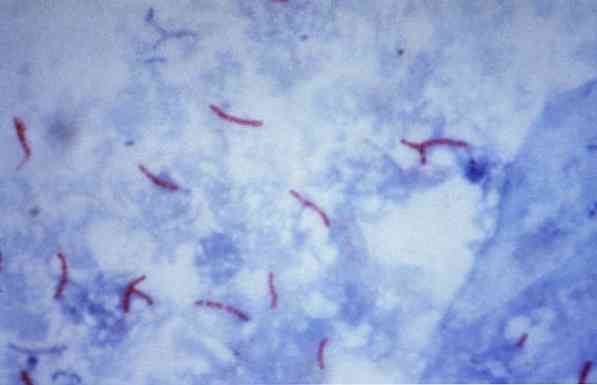
Μερικοί από αυτούς τους μικροοργανισμούς είναι μυκοβακτήρια (για παράδειγμα, Mycobacterium tuberculosis), nocardias (για παράδειγμα, Νocardia sp.) και μερικά μονοκύτταρα παράσιτα (για παράδειγμα, Cryptosporidium parvum). Πολλά από τα βακτήρια μπορούν να ταξινομηθούν μέσω μιας κοινής τεχνικής που ονομάζεται κηλίδωση Gram.
Ωστόσο, ορισμένες βακτηριακές ομάδες απαιτούν άλλες μεθόδους για την ταυτοποίησή τους. Τεχνικές όπως η χρώση Ziehl-Neelsen απαιτούν συνδυασμούς βαφών με θερμότητα για να στερεώσουν το πρώτο στο κυτταρικό τοίχωμα.
Στη συνέχεια έρχεται μια διαδικασία αποχρωματισμού που επιτρέπει δύο αποτελέσματα: αντοχή ή ευαισθησία σε αποχρωματισμό από οξέα και αλκοόλες.
Ευρετήριο
- 1 Ίδρυμα
- 1.1 Δευτερεύων χρωματισμός
- 2 Αντιδραστήρια
- 2.1 Πρωτογενής χρωματισμός
- 2.2 Αποχρωματιστικό διάλυμα
- 2.3 Δευτερεύων χρωματισμός (αντιχρωματικό)
- 3 Τεχνική
- 3.1 Διαδικασία χρώσης με οξύ οξύ
- 4 Αναφορές
Ίδρυμα
Η βάση αυτής της τεχνικής χρώσης βασίζεται στις ιδιότητες κυτταρικού τοιχώματος αυτών των μικροοργανισμών. Το τοίχωμα σχηματίζεται από έναν τύπο λιπαρών οξέων που ονομάζονται μυκολικά οξέα. Αυτά χαρακτηρίζονται από πολύ μεγάλες αλυσίδες.
Όταν τα λιπαρά οξέα έχουν πολύ μεγάλες δομές, μπορούν να διατηρούν τις βαφές πιο εύκολα. Ορισμένα γένη βακτηρίων είναι πολύ δύσκολο να λεκιάσουν με χρώση Gram, λόγω της υψηλής περιεκτικότητας σε μυκολικό οξύ του κυτταρικού τοιχώματος.
Στην κηλίδα Ziehl-Neelsen, χρησιμοποιείται η φαινολική ένωση carbol fuchsin, βασική βαφή. Αυτό έχει την ικανότητα να αλληλεπιδρά με τα λιπαρά οξέα του κυτταρικού τοιχώματος, το οποίο είναι κηρώδης υφή σε θερμοκρασία δωματίου.
χρώση φουξίνη καρβόλης ενισχύεται υπό την παρουσία θερμότητας, επειδή οι κερί λιώνει και τα μόρια χρωστικής κινούνται πιο γρήγορα μέσα στο κυτταρικό τοίχωμα.
Το οξύ που χρησιμοποιείται αργότερα χρησιμεύει για την αποχρωματισμό των κυττάρων που δεν είχαν χρωματιστεί επειδή το τοίχωμά τους δεν ήταν επαρκώς συνδεδεμένο με το χρωστικό. συνεπώς, η αντοχή του αποχρωματιστή οξέος είναι ικανή να απομακρύνει την όξινη βαφή. Τα κύτταρα που αντιστέκονται σε αυτόν τον αποχρωματισμό ονομάζονται ανθεκτικά στα οξέα.
Δευτερεύων χρωματισμός
Μετά τον αποχρωματισμό του δείγματος, αυτό έρχεται σε αντίθεση με μια άλλη χρωστική ουσία που ονομάζεται δευτερογενής βαφή. Χρησιμοποιείται γενικά το μπλε του κυανού ή το πράσινο του μαλαχίτη.
Η δευτερεύουσα χρωστική κηλιδώνει το υλικό φόντου και κατά συνέπεια δημιουργεί αντίθεση με τις δομές που βάφονται στο πρώτο βήμα. Μόνο τα αποχρωματισμένα κύτταρα απορροφούν τη δεύτερη βαφή (αντι-χρώση) και παίρνουν το χρώμα τους, ενώ τα ανθεκτικά σε οξύ κύτταρα διατηρούν το κόκκινο χρώμα.
Αυτή η διαδικασία χρησιμοποιείται συχνά για την αναγνώριση του Mycobacterium tuberculosis και Mycobacterium leprae, τα οποία ονομάζονται όξινα-γρήγορα βακίλλια.
Αντιδραστήρια
Πρωτογενής χρωματισμός
καρβολικής χρησιμοποιούνται φουξίνη 0,3% (διήθημα). Αυτή η χρωστική παρασκευάστηκε από ένα μίγμα των αλκοολών: φαινόλης σε αιθανόλη (90%) ή μεθανόλη (95%), και αυτό το μίγμα διαλύθηκε 3 γραμμάρια βασική φουξίνη.
Αποχρωματιστικό διάλυμα
Σε αυτό το στάδιο μπορείτε να χρησιμοποιήσετε διαλύματα 3% αλκοολικού οξέος ή 25% θειικού οξέος.
Δευτερεύων χρωματισμός (αντιδιαβρωτικό)
Η βαφή που χρησιμοποιείται συνήθως για την εκτέλεση της αντίθεσης στα δείγματα είναι συνήθως 0,3% κυανό του μεθυλενίου. Ωστόσο, μπορούν επίσης να χρησιμοποιηθούν και άλλα, όπως το 0,5% πράσινο μαλαχίτη.
Τεχνική
Διαδικασία βαφής με οξύ οξύ
Προετοιμάστε ένα βακτηριακό επίχρισμα
Αυτό το παρασκεύασμα γίνεται σε καθαρή και στεγνή ολίσθηση, ακολουθώντας τις προφυλάξεις για τη στειρότητα.
Ξήρανση του επιχρίσματος
Αφήστε το επίχρισμα να στεγνώσει σε θερμοκρασία δωματίου.
Ζεσταίνουμε το δείγμα
Το δείγμα πρέπει να θερμανθεί εφαρμόζοντας φωτιά στην κατωτέρα διαφάνεια. Μπορεί να κάνει μια στερέωση με αλκοόλη όταν το επίχρισμα δεν έχει προετοιμαστεί με πτύελα (κατεργασία με υποχλωριώδες νάτριο για να λευκαντικό) και αν όχι αμέσως να είναι βαμμένα.
Μ. Tuberculosis Εξαλείφεται με λευκαντικό και κατά τη διαδικασία χρώσης. Η θερμομόνωση των μη επεξεργασμένων πτυέλων δεν θα σκοτώσει Μ. Tuberculosis, ενώ η στερέωση με αλκοόλη είναι βακτηριοκτόνο.
Καλύψτε το λεκέ
Η κηλίδα καλύπτεται με το διάλυμα καρβολλικής φουξίνης (βασική βασική κηλίδα).
Ζεστάνετε το λεκέ
Αυτό γίνεται για 5 λεπτά. Θα πρέπει να παρατηρήσετε απελευθέρωση ατμού (περίπου 60 ° C). Είναι σημαντικό να μην υπερθερμαίνεται και να αποφεύγεται η καύση του δείγματος.
Όσον αφορά την θέρμανση του τόπου πρέπει να είναι πολύ προσεκτικοί για να θερμάνει το φουξίνη καρβόλης, ειδικά αν η χρώση πραγματοποιείται σε ένα δίσκο ή άλλο περιέκτη στον οποίο συλλέχθηκαν εύφλεκτες ουσίες προηγούμενη χρώση.
Μόνο μια μικρή φλόγα θα πρέπει να εφαρμόζεται κάτω από τις αντικειμενοφόρους πλάκες χρησιμοποιώντας ένα αναμμένο βαμβάκι που έχει προηγουμένως υγρανθεί με μερικές σταγόνες όξινου αλκοόλ, μεθανόλης ή 70% αιθανόλης. Αποφύγετε τη χρήση ενός μεγάλου βύσματος εμποτισμένου σε αιθανόλη, επειδή αυτό αποτελεί κίνδυνο πυρκαγιάς.
Πλύνετε το λεκέ
Αυτό το πλύσιμο πρέπει να γίνει με καθαρό νερό. Αν το νερό της βρύσης δεν είναι καθαρό, πλύνετε το επίχρισμα με φιλτραρισμένο ή απεσταγμένο νερό, κατά προτίμηση.
Καλύψτε το επίχρισμα με όξινη αλκοόλη
Αυτή η όξινη αλκοόλη θα πρέπει να είναι 3%. Η κάλυψη πραγματοποιείται για 5 λεπτά ή έως ότου η κηλίδα αποχρωματισθεί επαρκώς, δηλαδή ανοικτό ροζ.
Πρέπει να λαμβάνεται υπόψη ότι η όξινη αλκοόλη είναι εύφλεκτη. επομένως, πρέπει να χρησιμοποιείται πολύ προσεκτικά. Αποφύγετε να είστε κοντά σε πηγές ανάφλεξης.
Πλύνετε το λεκέ
Το πλύσιμο πρέπει να γίνεται με καθαρό, απεσταγμένο νερό.
Καλύψτε το επίχρισμα με βαφή
Μπορεί να είναι πράσινο μαλαχίτη (0,5%) ή βαφή μεθυλενίου (0,3%) για 1 ή 2 λεπτά, χρησιμοποιώντας το μακρύτερο χρόνο εάν το επίχρισμα είναι λεπτό.
Πλύνετε το λεκέ
Το καθαρό νερό πρέπει να χρησιμοποιηθεί και πάλι (απεσταγμένο).
Στραγγίστε
Σκουπίστε έξω το πίσω μέρος του ολισθητήρα και τοποθετήστε το έμπλαστρο σε αποστράγγισης ράφι, έτσι ώστε αυτό ξηρού αέρα (δεν χρησιμοποιούν απορροφητικό χαρτί για την ξήρανση).
Εξετάστε το επίχρισμα στο μικροσκόπιο
Ο στόχος 100X και το λάδι βύθισης θα πρέπει να χρησιμοποιούνται. Ελέγξτε συστηματικά το επίχρισμα και σημειώστε τις σχετικές παρατηρήσεις.
Ερμηνεύστε τα αποτελέσματα
Θεωρητικά, οι μικροοργανισμοί που είναι βαμμένοι με κοκκινωπό χρώμα θεωρούνται θετικοί σε οξύ (AAR +).
Αντίθετα, αν οι μικροοργανισμοί χρωματίζονται με μπλε ή πράσινο χρώμα, ανάλογα με τη χρωστική που χρησιμοποιείται ως αντίθετη βαφή, θεωρούνται αρνητικά ανθεκτικά στο αλκοόλ οξύ (AAR-).
Αναφορές
- Apurba, S. & Sandhya, Β. (2016). Βασικά στοιχεία της πρακτικής μικροβιολογίας (1η έκδοση). Jaypee Brothers Medical Εκδότες.
- Bauman, R. (2014). Μικροβιολογία με Ασθένειες με Σύστημα Σώματος (4η έκδοση). Pearson Education, Inc.
- Heritage, J., Evans, Ε. & Killington, Α. (1996). Εισαγωγική Μικροβιολογία (1η έκδοση). Cambridge University Press.
- Morello, J., Granato, Ρ. Wilson, Μ. & Morton, V. (2006). Εργαστηριακό Εγχειρίδιο και Βιβλίο Εργασίας στη Μικροβιολογία: Εφαρμογές στη Φροντίδα των Ασθενών (11η έκδοση). McGraw-Hill Εκπαίδευση.
- Vasanthakumari, R. (2007). Εγχειρίδιο μικροβιολογίας (1η έκδοση). Β.Ι. Δημοσιεύσεις PVT.


