Τύπος οξειδίου λιθίου, ιδιότητες, κίνδυνοι και χρήσεις
Το οξείδιο του λιθίου είναι μια ανόργανη χημική ένωση του τύπου Li2Ή που σχηματίζεται μαζί με μικρές ποσότητες υπεροξειδίου του λιθίου όταν το μέταλλο του λιθίου καίγεται στον αέρα και συνδυάζεται με οξυγόνο.
Μέχρι τη δεκαετία του 1990, στην αγορά μεταλλικών και λιθίου κυριαρχούσε η αμερικανική παραγωγή από κοιτάσματα ορυκτών, αλλά στις αρχές του 21ου αιώνα το μεγαλύτερο μέρος της παραγωγής προέρχεται από μη αμερικανικές πηγές. Η Αυστραλία, η Χιλή και η Πορτογαλία ήταν οι σημαντικότεροι προμηθευτές στον κόσμο. Η Βολιβία έχει τις μισές αποθέσεις λιθίου στον κόσμο, αλλά δεν είναι ένας μεγάλος παραγωγός.
Η πιο σημαντική εμπορική μορφή είναι το ανθρακικό λίθιο, Li2CO3, που παράγονται από ανόργανα άλατα ή αλατούχα με διάφορες διαφορετικές διεργασίες.
Όταν το λίθιο καίγεται στον αέρα, το κύριο προϊόν είναι το λευκό οξείδιο του λιθίου, το Li2O. Επιπλέον, παράγεται κάποιο υπεροξείδιο του λιθίου, Li2Ο2, επίσης λευκό.
Μπορεί επίσης να γίνει μέσω της θερμικής αποσύνθεσης του υδροξειδίου του λιθίου, του LiOH ή του υπεροξειδίου του λιθίου, του Li2O2
4Li (s) + Ο2(g) → 2Li2O (s)
2LiOH (s) + θερμότητα → Li2Ο (δ) + Η2O (g)
2Li2Ο2(ες) + θερμότητα → 2Li2O (s) + Ο2(ζ)
Φυσικές και χημικές ιδιότητες
Το οξείδιο του λιθίου είναι ένα λευκό στερεό γνωστό ως λίθια που δεν διαθέτει άρωμα και αλμυρή γεύση. Η εμφάνισή του φαίνεται στο Σχήμα 2 (Εθνικό Κέντρο Βιοτεχνολογικών Πληροφοριών, 2017).

Σχήμα 2: εμφάνιση οξειδίου του λιθίου
Τα οξείδια του λιθίου είναι κρύσταλλοι με γεωμετρία αντιφλορώτη παρόμοια με εκείνη του χλωριούχου νατρίου (κυβικά επικεντρωμένα στα πρόσωπα). Η κρυσταλλική της δομή παρουσιάζεται στο Σχήμα 3 (Mark Winter [The University of Sheffield και WebElements Ltd, 2016].
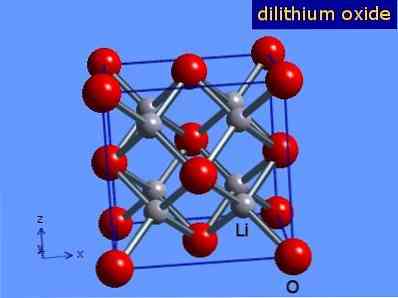
Σχήμα 3: κρυσταλλική δομή οξειδίου του λιθίου.
Το μοριακό βάρος του είναι 29,88 g / mol, η πυκνότητά του είναι 2,013 g / ml και τα σημεία τήξης και βρασμού είναι 1438 ° C και 2066 ° C αντίστοιχα. Η ένωση είναι πολύ διαλυτή σε νερό, αλκοόλη, αιθέρα, πυριδίνη και νιτροβενζόλιο (Royal Society of Chemistry, 2015).
Το οξείδιο του λιθίου αντιδρά εύκολα με υδρατμούς για να σχηματίσει υδροξείδιο και με διοξείδιο του άνθρακα για σχηματισμό ανθρακικού άλατος. επομένως, πρέπει να αποθηκεύεται και να γίνεται σε καθαρή και ξηρή ατμόσφαιρα.
Οι ενώσεις οξειδίου δεν οδηγούν σε ηλεκτρισμό. Ωστόσο, ορισμένα διαρθρωμένα περοβσκίτη οξείδια είναι ηλεκτρονικά αγώγιμα τα οποία χρησιμοποιούνται στην κάθοδο των κυψελών καυσίμου και συστήματα παραγωγής στερεό οξυγόνου οξειδίου.
Είναι ενώσεις που περιέχουν τουλάχιστον ένα ανιόν οξυγόνου και ένα μεταλλικό κατιόν (American Elements, S.F.).
Δραστικότητα και κίνδυνοι
Το οξείδιο του λιθίου είναι μια σταθερή ένωση ασυμβίβαστη με ισχυρά οξέα, νερό και διοξείδιο του άνθρακα. Από γνώση μας, οι χημικές, φυσικές και τοξικολογικές ιδιότητες του οξειδίου του λιθίου δεν έχουν διερευνηθεί και αναφερθεί σε βάθος.
Η τοξικότητα των ενώσεων λιθίου είναι συνάρτηση της διαλυτότητάς τους στο νερό. Το ιόν λιθίου έχει τοξικότητα στο κεντρικό νευρικό σύστημα. Η ένωση είναι ιδιαίτερα διαβρωτική ερεθιστική όταν έρχεται σε επαφή με τα μάτια, το δέρμα όταν εισπνέεται ή απορροφάται (ESPI METALS, 1993).
Σε περίπτωση επαφής με τα μάτια, θα πρέπει να ελέγξετε εάν φοράτε φακούς επαφής και να τα αφαιρέσετε αμέσως. Τα μάτια πρέπει να ξεπλένονται με τρεχούμενο νερό για τουλάχιστον 15 λεπτά, κρατώντας τα βλέφαρα ανοιχτά. Μπορείτε να χρησιμοποιήσετε κρύο νερό. Η αλοιφή δεν πρέπει να χρησιμοποιείται για τα μάτια.
Αν το χημικό έρχεται σε επαφή με τα ρούχα, αφαιρέστε το όσο το δυνατόν γρηγορότερα, προστατεύοντας τα χέρια και το σώμα σας. Τοποθετήστε το θύμα κάτω από ντους ασφαλείας.
Εάν η χημική συσσωρεύεται στο εκτεθειμένο δέρμα του θύματος, όπως τα χέρια, πλένεται απαλά και προσεκτικά το μολυσμένο δέρμα με τρεχούμενο νερό και ήπιο σαπούνι. Μπορείτε να χρησιμοποιήσετε κρύο νερό. Εάν ο ερεθισμός παραμένει, ζητήστε ιατρική βοήθεια. Πλύνετε τα μολυσμένα ρούχα πριν επαναχρησιμοποιήσετε.
Σε περίπτωση εισπνοής, το θύμα πρέπει να επιτρέπεται να ξεκουραστεί σε καλά αεριζόμενο χώρο. Εάν η εισπνοή είναι σοβαρή, το θύμα πρέπει να εκκενωθεί σε ασφαλή περιοχή το συντομότερο δυνατό.
Χαλαρώστε τα σφιχτά ρούχα, όπως κολάρο, ζώνες ή γραβάτα. Εάν το θύμα δυσκολεύεται να αναπνεύσει, πρέπει να χορηγείται οξυγόνο. Αν το θύμα δεν αναπνέει, πραγματοποιείται αναζωογόνηση από στόμα σε στόμα.
Λαμβάνοντας πάντα υπόψη ότι μπορεί να είναι επικίνδυνο για το άτομο που παρέχει βοήθεια να δώσει ανάνηψη στο στόμα όταν το εισπνεόμενο υλικό είναι τοξικό, μολυσματικό ή διαβρωτικό.
Σε όλες τις περιπτώσεις θα πρέπει να αναζητήσετε άμεση ιατρική φροντίδα (SIGMA-ALDRICH, 2010).
Χρησιμοποιεί
Το οξείδιο του λιθίου χρησιμοποιείται ως ροή σε κεραμικά βερνίκια και δημιουργεί μπλε χρώμα με χαλκό και τριαντάφυλλα με κοβάλτιο. Το οξείδιο του λιθίου αντιδρά με νερό και ατμό, σχηματίζοντας υδροξείδιο του λιθίου και πρέπει να απομονωθεί από αυτά.
Το οξείδιο του λιθίου (Li2O) με υψηλό δυναμικό για τρίτιο είναι μια ελκυστική υποψήφιος για το υλικό του στερεού καλλιέργειας ενός σταθμού παραγωγής ηλεκτρικής ενέργειας σύντηξης DT λόγω της υψηλής πυκνότητάς του ατόμων λιθίου (σε σύγκριση με άλλα κεραμικά λίθιο ή μεταλλικό λίθιο) και η αγωγιμότητα του σχετικά υψηλό θερμικό (ΟΞΕΙΔΙΟ ΛΙΘΙΟΥ (Li2O), SF).
Λι2Ή θα εκτεθεί σε υψηλές θερμοκρασίες υπό ακτινοβολία νετρονίων κατά τη διάρκεια της λειτουργίας των κουβερτών σύντηξης. Υπό αυτές τις συνθήκες, θα υπάρξει ένας μεγάλος αριθμός ελαττωμάτων ακτινοβολίας στο Li2Ή, όπως η διόγκωση που προκαλείται από ηλιο, η σχετικά υψηλή θερμική διαστολή, η ανάπτυξη κόκκων, ο σχηματισμός LiOH (T) και η καθίζηση σε χαμηλές θερμοκρασίες και η μεταφορά μάζας LiOH (T) σε υψηλές θερμοκρασίες.
Επιπλέον, το Λι2Ή θα υπόκειται σε πιέσεις που προκύπτουν από τις διαφορές στη θερμική διαστολή μεταξύ Li2O και δομικά υλικά. Αυτά τα χαρακτηριστικά του Li2Ή οδηγούν σε προκλητικά προβλήματα μηχανικής τόσο στην κατασκευή όσο και στη σχεδίαση της κουβέρτας.
Μια πιθανή νέα χρήση είναι σαν μία αντικατάσταση για το οξείδιο του κοβαλτίου και το λίθιο ως η κάθοδος στην λιθίου ιόντων λιθίου που χρησιμοποιείται για να τροφοδοτήσει ηλεκτρονικές συσκευές κινητών τηλεφώνων για φορητούς υπολογιστές, καθώς και αυτοκίνητα με μπαταρίες (Reade International Corp, 2016).
Αναφορές
- Mark Winter [Το Πανεπιστήμιο του Sheffield και το WebElements Ltd. (2016). webelements. Λαμβάνεται από το λιθίου: οξείδιο του διλιθίου webelements.com.
- Αμερικανικά Στοιχεία. (S.F.). Οξείδιο του λιθίου. Λαμβάνεται από americanelements americanelements.com.
- ESPI METALS. (1993, Ιούνιος). Οξείδιο του λιθίου. Λαμβάνεται από espimetals espimetals.com.
- ΟΞΕΙΔΙΟ ΛΙΘΙΟΥ (Li2O). (S.F.). Λαμβάνεται από ferp.ucsd.edu ferp.ucsd.edu.
- Εθνικό Κέντρο Βιοτεχνολογικών Πληροφοριών. (2017, 24 Ιουνίου). Δημοσιευμένη βάση δεδομένων PubChem. CID = 166630. Λαμβάνεται από το PubChem pubchem.ncbi.nlm.nih.gov.
- Η Reade International Corp. (2016). Οξείδιο του Λιθίου Σκόνη (Li2O). Λαμβάνεται από το reade reade.com
- Βασιλική Εταιρεία Χημείας. (2015). Οξείδιο του λιθίου.Από το chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Φύλλο δεδομένων ασφαλείας υλικών Οξείδιο του λιθίου. Από το chemblink chemblink.com.


