Δομή τετραχλωράνθρακα (CCl4), ιδιότητες, χρήσεις, τοξικότητα
Το τετραχλωράνθρακα Πρόκειται για ένα άχρωμο υγρό, με ελαφρώς γλυκιά οσμή, παρόμοιο με τη μυρωδιά του αιθέρα και του χλωροφορμίου. Ο χημικός τύπος του είναι CCl4, και αποτελεί μια ομοιοπολική και πτητική ένωση, της οποίας ο ατμός είναι μεγαλύτερης πυκνότητας από τον αέρα. Δεν είναι ευνοϊκό για την ηλεκτρική ενέργεια ούτε είναι εύφλεκτο.
Βρίσκεται στην ατμόσφαιρα, στο νερό των ποταμών, στη θάλασσα και στα ιζήματα της θαλάσσιας επιφάνειας. Θεωρείται ότι ο τετραχλωράνθρακας που υπάρχει στα κόκκινα άλγη συντίθεται από τον ίδιο οργανισμό.
Στην ατμόσφαιρα παράγεται από την αντίδραση του χλωρίου και του μεθανίου. Ο βιομηχανικώς παραγόμενος τετραχλωράνθρακας εισέρχεται στον ωκεανό, κυρίως μέσω της διασύνδεσης θαλάσσιου αέρα. Έχει υπολογιστεί ότι η ατμοσφαιρική ροή του => oceanic είναι 1,4 x 1010 g / έτος, που ισοδυναμεί με το 30% του συνολικού τετραχλωράνθρακα της ατμόσφαιρας.
Ευρετήριο
- 1 Κύρια χαρακτηριστικά
- 2 Δομή
- 3 Φυσικές και χημικές ιδιότητες
- 4 Χρήσεις
- 4.1 Χημική κατασκευή
- 4.2 Παραγωγή ψυκτικών μέσων
- 4.3 Καταστολή της φωτιάς
- 4.4 Καθαρισμός
- 4.5 Χημική ανάλυση
- 4.6 Φασματοσκοπία υπερύθρων και πυρηνικός μαγνητικός συντονισμός
- 4.7 Διαλύτης
- 4.8 Άλλες χρήσεις
- 5 Τοξικότητα
- 5.1 Ηπατοτοξικοί μηχανισμοί
- 5.2 Τοξικές επιδράσεις στο νεφρικό σύστημα και στο κεντρικό νευρικό σύστημα
- 5.3 Επιδράσεις της ανθρώπινης έκθεσης
- 5.4 Τοξικές αλληλεπιδράσεις
- 6 Διαμοριακές αλληλεπιδράσεις
- 7 Αναφορές
Κύρια χαρακτηριστικά
Τετραχλωράνθρακας παράγεται βιομηχανικά από θερμική χλωρίωση του μεθανίου με αντίδραση μεθανίου με αέριο χλώριο σε θερμοκρασία μεταξύ 400 ° C έως 430 ° C. Κατά τη διάρκεια της αντίδρασης παράγεται ένα ακατέργαστο προϊόν, με ένα παραπροϊόν υδροχλωρικού οξέος.
Παράγεται επίσης βιομηχανικά με τη μέθοδο του δισουλφιδίου άνθρακα. Το χλώριο και το δισουλφίδιο του άνθρακα αντιδρούν σε θερμοκρασία από 90 ° C έως 100 ° C, χρησιμοποιώντας σίδηρο ως καταλύτη. Στη συνέχεια, το ακατέργαστο προϊόν υποβάλλεται σε κλασμάτωση, εξουδετέρωση και απόσταξη.
Το CCl4 έχει πολλαπλές χρήσεις, μεταξύ άλλων: διαλύτης λίπους, έλαια, βερνίκια κ.λπ. στεγνό καθάρισμα ρούχων. φυτοφαρμάκων, στον αγροτικό και μυκητοκτόνο υποκαπνισμό και στην κατασκευή νάιλον. Ωστόσο, παρά τη μεγάλη χρησιμότητά του, η χρήση του έχει αποκλειστεί εν μέρει λόγω της υψηλής τοξικότητας.
Στους ανθρώπους, δημιουργεί τοξικές επιδράσεις στο δέρμα, τα μάτια και την αναπνευστική οδό. Αλλά οι πιο επιβλαβείς επιδράσεις της εμφανίζονται στη λειτουργία του κεντρικού νευρικού συστήματος, του ήπατος και των νεφρών. Η βλάβη των νεφρών είναι ίσως η κύρια αιτία θανάτων που αποδίδονται στην τοξική δράση του τετραχλωράνθρακα.
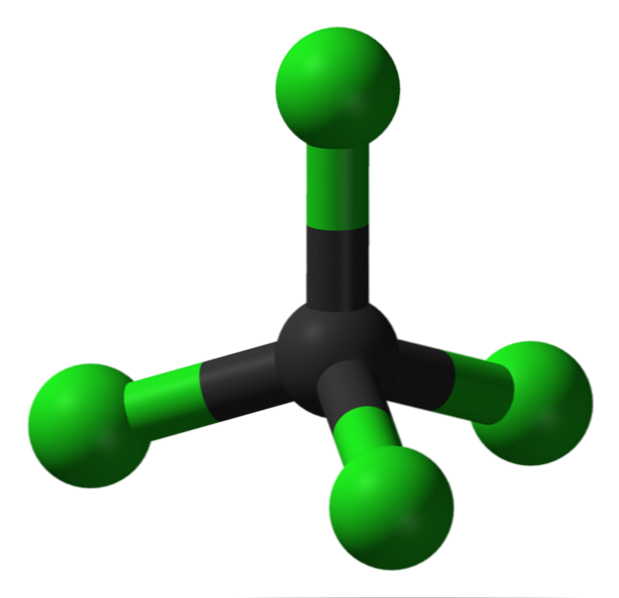
Δομή
Στην εικόνα μπορείτε να δείτε τη δομή του τετραχλωριούχου άνθρακα, που είναι τετραεδρική γεωμετρία. Σημειώστε ότι τα άτομα Cl (οι πράσινες σφαίρες) προσανατολίζονται στο χώρο γύρω από τον άνθρακα (μαύρη σφαίρα) με το σχέδιο τετράεδρου.
Επίσης, αξίζει να σημειωθεί ότι επειδή όλες οι κορυφές του τετραεδριού είναι πανομοιότυπες, η δομή είναι συμμετρική. δηλαδή, δεν έχει σημασία πώς περιστρέφεται το μόριο CCl4, Θα είναι πάντα το ίδιο. Στη συνέχεια, από το πράσινο τετράεδρο CCl4 είναι συμμετρική, έχει σαν συνέπεια την απουσία μιας μόνιμης διπολικής ροπής.
Γιατί; Επειδή παρόλο που οι δεσμοί C-Cl είναι πολικοί λόγω της μεγαλύτερης ηλεκτροαρνητικότητας του Cl σε σχέση με τον C, αυτές οι στιγμές ακυρώνονται διανυσματικά. Ως εκ τούτου, είναι μια απολίνουσα χλωριωμένη οργανική ένωση.
Ο άνθρακας είναι πλήρως χλωριωμένος στο CCl4, τι είναι ίση με μια υψηλή οξείδωση (ο άνθρακας μπορεί να σχηματίσει το μέγιστο τέσσερις δεσμούς με χλώριο). Αυτός ο διαλύτης δεν έχει την τάση να χάνει τα ηλεκτρόνια, είναι απρωτικός (δεν έχει υδρογόνα) και αντιπροσωπεύει ένα μέσο μεταφοράς και μικρή αποθήκευση χλωρίου..
Φυσικές και χημικές ιδιότητες
Φόρμουλα
CCl4
Μοριακό βάρος
153,81 g / mol.
Φυσική εμφάνιση
Πρόκειται για ένα άχρωμο υγρό. Κρυσταλλώνεται με τη μορφή μονοκλινικών κρυστάλλων.
Οσμή
Παρουσιάζει τη χαρακτηριστική οσμή που υπάρχει σε άλλους χλωριωμένους διαλύτες. Η μυρωδιά είναι αρωματική και κάπως γλυκιά, παρόμοια με τη μυρωδιά του τετραχλωροαιθυλενίου και του χλωροφορμίου.
Σημείο ζέσεως
170,1 ° F (76,8 ° C) έως 760 mmHg.
Σημείο τήξης
-9 ° F (-23 ° C).
Διαλυτότητα στο νερό
Είναι ελάχιστα διαλυτό σε νερό: 1,16 mg / mL στους 25 ° C και 0,8 mg / mL στους 20 ° C. Γιατί; Επειδή το νερό, ένα πολύ πολικό μόριο, δεν "αισθάνεται" μια συγγένεια για το τετραχλωράνθρακα, το οποίο είναι απολιθικό.
Διαλυτότητα σε οργανικούς διαλύτες
Λόγω της συμμετρίας της μοριακής του δομής, ο τετραχλωράνθρακας είναι μια μη πολική ένωση. Ως εκ τούτου, είναι αναμίξιμο με αλκοόλη, βενζόλιο, χλωροφόρμιο, αιθέρα, διθειάνθρακα, πετρελαϊκό αιθέρα και νάφθα. Ομοίως, είναι διαλυτό σε αιθανόλη και ακετόνη.
Πυκνότητα
Σε υγρή κατάσταση: 1,59 g / ml στους 68 ° F και 1,594 g / ml στους 20 ° C.
Σε στερεή κατάσταση: 1,831 g / ml στους -186 ° C και 1,809 g / ml στους -80 ° C.
Σταθερότητα
Γενικά αδρανής.
Διαβρωτική δράση
Προσβάλλει μερικές μορφές πλαστικών, ελαστικών και επικαλύψεων.
Σημείο ανάφλεξης
Θεωρείται ότι δεν είναι πολύ εύφλεκτο, δηλώνοντας το σημείο ανάφλεξης ως λιγότερο από 982 ºC.
Αυτόματη ανάφλεξη
982 ° C (1800 ° Ρ · 1255 Κ).
Πυκνότητα ατμών
5.32 σε σχέση με τον αέρα, που λαμβάνεται ως τιμή αναφοράς ίση με 1.
Πίεση ατμού
91 mmHg στους 68 ° F. 113 mmHg στους 77 ° F και 115 mmHg στους 25 ° C.
Αποσύνθεση
Παρουσία πυρκαγιών σχηματίζει χλωρίδιο και φωσγένιο, έντονα τοξική ένωση. Ομοίως, υπό τις ίδιες συνθήκες, αποσυντίθεται σε υδροχλώριο και μονοξείδιο του άνθρακα. Υπό την παρουσία νερού σε υψηλές θερμοκρασίες, μπορεί να προκαλέσει υδροχλωρικό οξύ.
Ιξώδες
2,03 χ 10-3 Pa
Όριο οσμής
21,4 ppm.
Δείκτης διάθλασης (ηϋ)
1,4607.
Χρησιμοποιεί
Χημική κατασκευή
-Λειτουργεί ως παράγοντας χλωρίωσης και / ή διαλύτη στην παρασκευή οργανικού χλωρίου. Ομοίως, παρεμβαίνει ως μονομερές στην κατασκευή νάυλον.
-Λειτουργεί ως διαλύτης στην κατασκευή τσιμέντου από καουτσούκ, σαπουνιού και εντομοκτόνου.
-Χρησιμοποιείται στην κατασκευή προωθητικού χλωροφθορανθράκων.
-Που δεν συνδέονται καθόλου C-H, τετραχλωράνθρακα δεν υφίστανται αντιδράσεις ελευθέρων ριζών, γι 'αυτό είναι ένα χρήσιμο διαλύτη για την αλογόνωση, είτε μια στοιχειώδη αλογόνο ή ένα αντιδραστήριο αλογόνωσης όπως Ν-βρωμοηλεκτριμίδιο.
Κατασκευή ψυκτικών μέσων
Χρησιμοποιήθηκε στην παραγωγή χλωροφθορανθράκων, ψυκτικού R-11 και τριχλωροφθορομεθανίου, ψυκτικού μέσου R-12. Αυτά τα ψυκτικά μέσα καταστρέφουν τη στιβάδα του όζοντος, γι 'αυτό συνέστησαν την παύση της χρήσης τους, σύμφωνα με τις συστάσεις του πρωτοκόλλου του Μόντρεαλ.
Καταστολή της φωτιάς
Στις αρχές του 20ου αιώνα, ο τετραχλωράνθρακας άρχισε να χρησιμοποιείται ως πυροσβεστήρας, με βάση ένα σύνολο ιδιοτήτων της ένωσης: είναι πτητικό. ο ατμός του είναι βαρύτερος από τον αέρα. Δεν είναι ένας ηλεκτρικός αγωγός και δεν είναι πολύ εύφλεκτο.
Όταν τετραχλωράνθρακα θερμαίνεται γίνεται ένα βαρύ ατμού καλύπτει προϊόντα καύσης, απομονώνοντας το οξυγόνο του αέρα και προκαλώντας η φωτιά σβήνει. Είναι κατάλληλο για την καταπολέμηση πυρκαγιών και συσκευών πετρελαίου.
Ωστόσο, σε θερμοκρασίες άνω των 500 ° C τετραχλωράνθρακα ενδέχεται να αντιδράσει με το νερό που προκύπτει φωσγένιο, τοξική ένωση, έτσι πρέπει να δοθεί προσοχή στον εξαερισμό κατά τη διάρκεια της χρήσης. Επιπλέον, μπορεί να αντιδρά εκρηκτικά με μεταλλικό νάτριο, αποφεύγοντας τη χρήση του σε πυρκαγιές με την παρουσία αυτού του μετάλλου.
Καθαρισμός
Τετραχλωριούχος άνθρακας έχει χρησιμοποιηθεί για τον στεγνό καθαρισμό ρούχων και άλλων υλικών για χρήση στο σπίτι. Επίσης, χρησιμοποιεί ως ένα εξαιρετικό μέταλλα βιομηχανική απολίπανση να διαλύσει το λίπος και το λάδι.
Χημική ανάλυση
Χρησιμοποιείται για την ανίχνευση βορίου, βρωμίου, χλωριούχου, μολυβδαινίου, βολφραμίου, βαναδίου, φωσφόρου και αργύρου.
Φασματοσκοπία υπερύθρων και πυρηνικός μαγνητικός συντονισμός
-Χρησιμοποιείται ως διαλύτης σε υπέρυθρη φασματοσκοπία, δεδομένου ότι το τετραχλωράνθρακα δεν έχει σημαντική απορρόφηση σε ζώνες> 1600 cm-1.
-Χρησιμοποιήθηκε ως διαλύτης σε πυρηνικό μαγνητικό συντονισμό, αφού δεν παρεμβαίνει στην τεχνική διότι δεν διαθέτει υδρογόνο (είναι απρωτικό). Αλλά λόγω της τοξικότητάς του και λόγω της χαμηλής ισχύος του διαλύτη, ο τετραχλωράνθρακας έχει αντικατασταθεί από δευτεριωμένους διαλύτες..
Διαλύτης
Τα χαρακτηριστικά ενός μη-πολική ένωση επιτρέπει τη χρήση τετραχλωράνθρακα ως διαλύτη παράγοντας των ελαίων, λιπών, λάκκες, βερνίκια, κηροί, καουτσούκ και ρητίνες. Μπορεί επίσης να διαλύσει το ιώδιο.
Άλλες χρήσεις
-Είναι ένα σημαντικό συστατικό στους λαμπτήρες λάβας, καθώς λόγω της πυκνότητάς του ο τετραχλωράνθρακας προσθέτει βάρος στο κερί.
-Χρησιμοποιείται από τους συλλέκτες γραμματοσήμων, καθώς αποκαλύπτει υδατογραφήματα στα γραμματόσημα χωρίς να προκαλούν ζημιές.
-Έχει χρησιμοποιηθεί ως παρασιτοκτόνο, μυκητοκτόνο και στον ψεκασμό σπόρων για την εξάλειψη των εντόμων.
-Στη διαδικασία κοπής μετάλλου χρησιμοποιείται ως λιπαντικό.
-Έχει χρησιμοποιηθεί στην κτηνιατρική ως ανθελμινθικό για τη θεραπεία της φαστικολάσης, που προκαλείται από το Fasciola hepatica στα πρόβατα.
Τοξικότητα
-Το τετραχλωράνθρακα μπορεί να απορροφηθεί μέσω των αναπνευστικών, πεπτικών, οφθαλμικών και δερματικών οδών. Η κατάποση και η εισπνοή είναι πολύ επικίνδυνες επειδή μπορούν να προκαλέσουν μακροχρόνια σοβαρή βλάβη στον εγκέφαλο, το ήπαρ και τους νεφρούς.
-Η επαφή με το δέρμα προκαλεί ερεθισμό και μακροπρόθεσμα μπορεί να προκαλέσει δερματίτιδα. Ενώ η επαφή με τα μάτια προκαλεί ερεθισμό.
Ηπατοτοξικοί μηχανισμοί
Οι κύριοι μηχανισμοί που προκαλούν ηπατική βλάβη είναι οξειδωτικό στρες και η αλλοίωση της ομοιόστασης του ασβεστίου..
Το οξειδωτικό στρες είναι μια ανισορροπία μεταξύ της παραγωγής δραστικών ειδών οξυγόνου και την ικανότητα του σώματος να παράγει ένα αναγωγικό περιβάλλον εντός των κυττάρων τους, ελέγχοντας οξειδωτικές διαδικασίες.
Η ανισορροπία στην κανονική κατάσταση οξειδοαναγωγής μπορεί να προκαλέσει τοξικά αποτελέσματα με την παραγωγή υπεροξειδίων και ελεύθερων ριζών που βλάπτουν όλα τα συστατικά των κυττάρων.
Το τετραχλωράνθρακα μεταβολίζεται παράγοντας ελεύθερες ρίζες: Cl3Γ. (ρίζα τριχλωρομεθυλίου) και Cl3COO. (ριζικό τριχλωρομεθυλο-υπεροξείδιο). Αυτές οι ελεύθερες ρίζες προκαλούν λιποϋπεροξείδωση, η οποία προκαλεί βλάβη στο ήπαρ και επίσης στον πνεύμονα.
Οι ελεύθερες ρίζες προκαλούν επίσης τη ρήξη της μεμβράνης πλάσματος των ηπατικών κυττάρων. Αυτό προκαλεί αύξηση της κυτοσολικής συγκέντρωσης ασβεστίου και μείωση του ενδοκυτταρικού μηχανισμού της απομόνωσης του ασβεστίου.
Η ενδοκυτταρική αύξηση του ασβεστίου ενεργοποιεί το ένζυμο φωσφολιπάση Α2 που δρα στα φωσφολιπίδια της μεμβράνης, επιδεινώνοντας την επίδρασή της. Επιπλέον, υπάρχει διείσδυση ουδετερόφιλων και ηπατοκυτταρική βλάβη. Υπάρχει μια μείωση στην κυτταρική συγκέντρωση ΑΤΡ και γλουταθειόνης που προκαλεί ενζυματική απενεργοποίηση και κυτταρικό θάνατο.
Τοξικές επιδράσεις στο νεφρικό σύστημα και στο κεντρικό νευρικό σύστημα
Οι τοξικές επιδράσεις του τετραχλωράνθρακα εκδηλώνονται στο νεφρικό σύστημα με μείωση στην παραγωγή συσσώρευσης ούρων και σώματος. Ειδικά στους πνεύμονες και αύξηση της συγκέντρωσης των μεταβολικών αποβλήτων στο αίμα. Αυτό μπορεί να προκαλέσει θάνατο.
Στο επίπεδο του κεντρικού νευρικού συστήματος, υπάρχει εμπλοκή της αξονικής αγωγής των νευρικών παρορμήσεων.
Επιδράσεις της ανθρώπινης έκθεσης
Σύντομη διάρκεια
Ερεθισμός των οφθαλμών. οι επιδράσεις στο ήπαρ, στους νεφρούς και στο κεντρικό νευρικό σύστημα μπορεί να οδηγήσουν σε απώλεια συνείδησης.
Μεγάλη διάρκεια
Δερματίτιδα και πιθανή καρκινογόνος δράση.
Τοξικές αλληλεπιδράσεις
Υπάρχει μια συσχέτιση μεταξύ πολλών από τις περιπτώσεις δηλητηρίασης με τετραχλωράνθρακα και την κατανάλωση οινοπνεύματος. Η υπερβολική πρόσληψη αλκοόλ προκαλεί ηπατική βλάβη προκαλώντας κίρρωση του ήπατος σε ορισμένες περιπτώσεις.
Έχει παρατηρηθεί ότι η τοξικότητα του τετραχλωράνθρακα αυξάνεται με τα βαρβιτουρικά, καθώς αυτά έχουν κάποιες παρόμοιες τοξικές επιδράσεις.
Για παράδειγμα, στο νεφρικό επίπεδο, τα βαρβιτουρικά μειώνουν την απέκκριση των ούρων, η δράση των βαρβιτουρικών είναι παρόμοια με την τοξική επίδραση του τετραχλωράνθρακα στη νεφρική λειτουργία.
Διαμοριακές αλληλεπιδράσεις
Το CCl4 Μπορεί να θεωρηθεί ως πράσινο τετράεδρο. Πώς αλληλεπιδρά με άλλους?
Όντας ένα αποπολικό μόριο, χωρίς μόνιμη διπολική ροπή, δεν μπορεί να αλληλεπιδράσει με δυνάμεις δίπολο-διπόλης. Για να συγκρατήσουν τα μόρια μαζί στο υγρό, τα άτομα χλωρίου (οι κορυφές του τετραέδρου) πρέπει να αλληλεπιδρούν μεταξύ τους με κάποιο τρόπο. και επιτυγχάνουν χάρη στις δυνάμεις διασποράς του Λονδίνου.
Τα ηλεκτρονικά σύννεφα των ατόμων Cl μετακινούνται και για σύντομες στιγμές δημιουργούν πλούσιες και φτωχές περιοχές ηλεκτρονίων. Δηλαδή, παράγουν στιγμιαία δίπολα.
Η πλούσια περιοχή των ηλεκτρονίων δ- προκαλεί την πόλωση του ατόμου Cl ενός γειτονικού μορίου: Clδ-δ+Έτσι, δύο άτομα Cl μπορούν να συγκρατούνται μαζί για περιορισμένο χρονικό διάστημα.
Όμως, έχοντας εκατομμύρια μόρια CCl4, οι αλληλεπιδράσεις καθίστανται επαρκώς αποτελεσματικές ώστε να σχηματίζουν ένα υγρό υπό κανονικές συνθήκες.
Επιπλέον, τα τέσσερα CI που συνδέονται ομοιοπολικά με κάθε C αυξάνουν σημαντικά τον αριθμό αυτών των αλληλεπιδράσεων. τόσο πολύ, που βράζει στους 76,8 ° C, ένα υψηλό σημείο βρασμού.
Το σημείο βρασμού του CCl4 δεν μπορεί να είναι υψηλότερη επειδή τα τετράεδρα είναι σχετικά μικρά σε σύγκριση με άλλες απολικές ενώσεις (όπως το ξυλόλιο, το οποίο βράζει στους 144ºC).
Αναφορές
- Hardinger A. Steven. (2017). Εικονογραφημένο Γλωσσάριο Οργανικής Χημείας: Τετραχλωριούχος άνθρακας. Ανακτήθηκε από: chem.ucla.edu
- Όλα τα Σιαβάλα. (s.f.). Διαμοριακές και Διατοτομικές Δυνάμεις. Ανακτήθηκε από: siyavula.com
- Carey Ρ. Α. (2006). Οργανική Χημεία (Έκτη έκδοση). Mc Graw Hill.
- Wikipedia. (2018). Τετραχλωριούχος άνθρακας. Ανακτήθηκε από: en.wikipedia.org
- PubChem. (2018). Τετραχλωριούχος άνθρακας. Ανακτήθηκε από: pubchem.ncbi.nlm.nih.gov
- Chemical Book. (2017). Τετραχλωριούχος άνθρακας. Ανακτήθηκε από: chembook.com


