Θεωρία της Θάλασσας των Ηλεκτρονίων Βασικές αρχές, ιδιότητες και μειονεκτήματα
Το ηλεκτρονική θεωρία των ηλεκτρονίων Είναι μια υπόθεση που εξηγεί ένα εξαιρετικό χημικό φαινόμενο που συμβαίνει σε μεταλλικούς δεσμούς μεταξύ στοιχείων με χαμηλές ηλεκτροαρνησίες. Πρόκειται για την κατανομή ηλεκτρονίων μεταξύ διαφορετικών ατόμων που συνδέονται με μεταλλικούς δεσμούς.
Η ηλεκτρονική πυκνότητα μεταξύ αυτών των συνδέσεων είναι τέτοια ώστε τα ηλεκτρόνια να απομακρύνονται και να σχηματίζουν μια «θάλασσα» όπου κινούνται ελεύθερα. Μπορεί επίσης να εκφράζεται από την κβαντική μηχανική: μερικοί ηλεκτρόνια (συνήθως έχουν επτά παρα ένα άτομο) διατάσσονται σε πολλαπλά κέντρα τροχιακά που απλώνονται από την μεταλλική επιφάνεια.
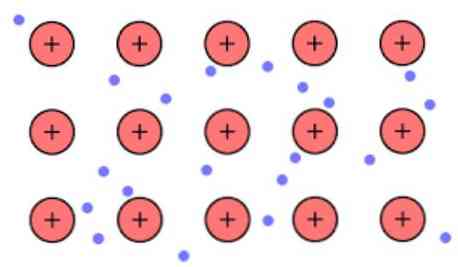
Επίσης, τα ηλεκτρόνια διατηρούν κάποια θέση στο μέταλλο, αν και η κατανομή πιθανοτήτων του ηλεκτρονικού σύννεφου έχει υψηλότερη πυκνότητα γύρω από ορισμένα συγκεκριμένα άτομα. Αυτό οφείλεται στο γεγονός ότι κατά την εφαρμογή ενός συγκεκριμένου ρεύματος δείχνουν την αγωγιμότητά τους σε μια συγκεκριμένη κατεύθυνση.
Ευρετήριο
- 1 Θεμελιώδη στοιχεία της θεωρίας της θάλασσας των ηλεκτρονίων
- 2 Ιδιότητες
- 2.1 Μετατόπιση με τη μορφή στρώσεων
- 2.2 Θεωρία της θάλασσας των ηλεκτρονίων σε μεταλλικούς κρυστάλλους
- 3 Μειονεκτήματα της θεωρίας
- 4 Αναφορές
Θεμελιώδη στοιχεία της θεωρίας της θάλασσας των ηλεκτρονίων
Τα μεταλλικά στοιχεία έχουν μεγάλη τάση να δώσουν ηλεκτρόνια από το τελευταίο ενεργειακό τους επίπεδο (στρώμα σθένους), λόγω της χαμηλής ενέργειας ιοντισμού τους σε σχέση με τα άλλα στοιχεία.
Γνωρίζοντας αυτό, κάθε μεταλλικό στοιχείο θα μπορούσε να θεωρηθεί ως ένα κατιόν που συνδέεται με το ηλεκτρόνιο του τελευταίου ενεργειακού του επιπέδου, το οποίο θα ήταν πιο επιρρεπές να δωρίσει.
Ως ένα μέταλλο που έχει ένα μεγάλο αριθμό ατόμων που συνδέονται μεταξύ τους, μπορεί να υποτεθεί ότι το μέταλλο σχηματίζει μια ομάδα μεταλλικών κατιόντων που βυθίζεται σε ένα είδος θάλασσα ηλεκτρονίων σθένους που έχουν ένα μεγάλο μετεγκατάστασης.
Ότι οι ηλεκτροστατικές δυνάμεις έλξης μεταξύ του κατιόντος (θετικό φορτίο) και ηλεκτρονίου (αρνητικό φορτίο) έχουν άτομα μετάλλων συνδεδεμένα φαντάζεται έντονα μετεγκατάστασης των ηλεκτρονίων σθένους συμπεριφέρεται όπως ένα ηλεκτροστατικό συγκολλητικό διατηρεί συνδέονται στα μεταλλικά κατιόντα.
Με αυτό τον τρόπο, μπορεί να συναχθεί ότι όσο μεγαλύτερος είναι ο αριθμός των ηλεκτρονίων που υπάρχουν στο στρώμα σθένους ενός μετάλλου, αυτό το είδος ηλεκτροστατικής κόλλας θα έχει μεγαλύτερη αντοχή.
Ιδιότητες
Η θεωρία της θάλασσας των ηλεκτρονίων προσφέρει μια απλή εξήγηση στα χαρακτηριστικά των μεταλλικών ειδών όπως η αντίσταση, η αγωγιμότητα, η ολκιμότητα και η ελαχιστοποίηση, τα οποία ποικίλλουν από το ένα μέταλλο στο άλλο.
Έχει ανακαλυφθεί ότι η αντίσταση που παρέχεται στα μέταλλα οφείλεται στη μεγάλη απομάκρυνση των ηλεκτρονίων τους, η οποία δημιουργεί μια πολύ υψηλή δύναμη συνοχής μεταξύ των ατόμων που το σχηματίζουν.
Με τον τρόπο αυτό, η ολκιμότητα είναι γνωστή ως η ικανότητα ορισμένων υλικών να επιτρέπουν την παραμόρφωση της δομής τους, χωρίς να παράγουν αρκετό για να σπάσουν, όταν υποβάλλονται σε ορισμένες δυνάμεις.
Offshoring με τη μορφή στρώσεων
Τόσο η ολκιμότητα και η πλαστικότητα των μετάλλων που καθορίζονται από το γεγονός ότι τα ηλεκτρόνια σθένους μετατοπισμένο προς όλες τις κατευθύνσεις σε στρώματα, που τους αναγκάζει να κινείται πάνω από το ένα το άλλο κατά τη δράση μιας εξωτερικής δύναμης, αποφεύγοντας την κατάρρευση της δομής του μετάλλου, αλλά επιτρέποντας την παραμόρφωσή του.
Ομοίως, η ελευθερία κινήσεως των μετεγκατεστημένων ηλεκτρονίων επιτρέπει να υπάρχει ροή ηλεκτρικού ρεύματος, καθιστώντας τα μέταλλα πολύ καλή αγωγιμότητα ηλεκτρισμού.
Επιπλέον, αυτό το φαινόμενο της ελεύθερης κίνησης των ηλεκτρονίων επιτρέπει τη μεταφορά κινητικής ενέργειας μεταξύ των διαφόρων περιοχών του μετάλλου, η οποία προάγει τη μετάδοση της θερμότητας και προκαλεί μεγάλη μεταβολή της θερμικής αγωγιμότητας.
Θεωρία της θάλασσας των ηλεκτρονίων σε μεταλλικούς κρυστάλλους
Οι κρύσταλλοι είναι στερεά τα οποία έχουν φυσικές και χημικές ιδιότητες όπως η πυκνότητα, σημείο τήξεως και σκληρά που είναι εγκατεστημένοι από το είδος των δυνάμεων που κάνουν τα σωματίδια που κολλούν μαζί σχηματίζουν.
Κατά κάποιον τρόπο, θεωρείται ότι οι κρύσταλλοι μεταλλικού τύπου έχουν τις απλούστερες δομές, επειδή κάθε "σημείο" του κρυσταλλικού δικτύου έχει καταληφθεί από ένα άτομο του ίδιου του μετάλλου.
Με την ίδια έννοια, έχει διαπιστωθεί ότι γενικά η δομή των μεταλλικών κρυστάλλων είναι κυβική και επικεντρώνεται στα πρόσωπα ή στο σώμα.
Ωστόσο, αυτά τα είδη μπορούν επίσης να έχουν εξαγωνικό σχήμα και να έχουν μια αρκετά συμπαγή συσκευασία, η οποία τους δίνει την τεράστια πυκνότητα που είναι χαρακτηριστική.
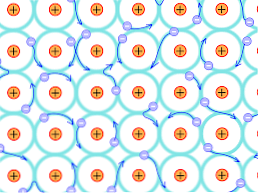
Λόγω αυτού του δομικού λόγου, οι δεσμοί που σχηματίζονται στους μεταλλικούς κρυστάλλους είναι διαφορετικοί από εκείνους που συμβαίνουν στα άλλα είδη κρυστάλλων. Τα ηλεκτρόνια που μπορούν να σχηματίσουν δεσμούς απομακρύνονται σε όλη την κρυσταλλική δομή, όπως εξηγείται παραπάνω.
Μειονεκτήματα της θεωρίας
Στα μεταλλικά άτομα υπάρχει μια μικρή ποσότητα ηλεκτρόνων σθένους ανάλογα με τα ενεργειακά τους επίπεδα. δηλαδή, υπάρχει μεγαλύτερη ποσότητα διαθέσιμων ενεργειακών καταστάσεων από την ποσότητα των συνδεδεμένων ηλεκτρονίων.
Αυτό συνεπάγεται ότι, δεδομένου ότι υπάρχει μια ισχυρή ηλεκτρονική μετεγκατάσταση και ενεργειακές ζώνες που έχουν γεμίσει μερικώς, τα ηλεκτρόνια μπορούν να κινηθούν μέσα από τη δομή πλέγματος όταν υποβάλλεται σε από το ηλεκτρικό πεδίο από το εξωτερικό, εκτός από τον σχηματισμό του ηλεκτρονίου ωκεανό που υποστηρίζει τη διαπερατότητα του δικτύου.
Έτσι, η ένωση των μετάλλων ερμηνεύεται ως ένα συσσωμάτωμα θετικά φορτισμένων ιόντων σε συνδυασμό με μια θάλασσα ηλεκτρονίων (αρνητικά φορτισμένων).
Ωστόσο, υπάρχουν χαρακτηριστικά που δεν εξηγούνται από αυτό το μοντέλο, όπως ο σχηματισμός ορισμένων κραμάτων μεταξύ μετάλλων με ειδικές συνθέσεις ή η σταθερότητα των συλλογικών μεταλλικών συνδέσμων, μεταξύ άλλων..
Αυτά τα μειονεκτήματα εξηγούνται από την κβαντική μηχανική, γιατί έχουν τόσο η θεωρία πολλές άλλες προσεγγίσεις έχουν συσταθεί με βάση το πιο απλό μοντέλο ενός ηλεκτρονίου, ενώ προσπαθεί να εφαρμόσει σε πιο σύνθετες δομές των ατόμων πολυηλεκτρονιακές.
Αναφορές
- Wikipedia. (2018). Wikipedia. Ανακτήθηκε από en.wikipedia.org
- Holman, J.S., and Stone, Ρ. (2001). Χημεία Ανακτήθηκε από το books.google.co.ve
- Parkin, G. (2010). Μεταλλική συγκόλληση. Ανακτήθηκε από το books.google.co.ve
- Rohrer, G.S (2001). Δομή και συγκόλληση σε κρυσταλλικά υλικά. Ανακτήθηκε από το books.google.co.ve
- Ibach, Η., Και Lüth, Η. (2009). Φυσική Στερεάς Κατάστασης: Εισαγωγή στις Αρχές της Επιστήμης των Υλικών. Ανακτήθηκε από το books.google.co.ve


