Αλουμίνιο Σουλφίδιο (Al2S3) Χημική Δομή, Ονοματολογία, Ιδιότητες
Το θειούχο αργίλιο (Al2S3) Είναι μια ένωση ελαφρύ χημικό γκρι που σχηματίζεται από την οξείδωση του μεταλλικού αλουμινίου για να χάσουν ηλεκτρόνια επίπεδο τελευταία ενέργεια και να γίνει κατιόν, και με τη μείωση του μη μεταλλικά θείου, κερδίζοντας τα ηλεκτρόνια δίνεται από αλουμίνιο και να γίνει μια ανιόν.
Για να συμβεί αυτό και το αλουμίνιο μπορεί να αποδώσει τα ηλεκτρόνια του, είναι απαραίτητο να παρουσιάσουμε τρία υβριδικά τροχιακά sp3, που δίνουν τη δυνατότητα σχηματισμού δεσμών με ηλεκτρόνια από θείο.

Η ευαισθησία του θειούχου αλουμινίου στο νερό σημαίνει ότι, παρουσία υδρατμών στον αέρα, μπορεί να αντιδράσει για να παράγει υδροξείδιο του αργιλίου (Al (OH)).3), υδρόθειο (Η2S) και υδρογόνο (Η2αέρια? αν το τελευταίο συσσωρευτεί μπορεί να προκαλέσει έκρηξη. Ως εκ τούτου, η συσκευασία του θειούχου αλουμινίου πρέπει να γίνεται με αεροστεγή δοχεία.
Από την άλλη πλευρά, επειδή το θειούχο αργίλιο έχει αντιδραστικότητα με το νερό, αυτό το καθιστά ένα στοιχείο που δεν έχει διαλυτότητα στον εν λόγω διαλύτη.
Ευρετήριο
- 1 Χημική δομή
- 1.1 Μοριακός τύπος
- 1.2 Δομική δομή
- 2 Ιδιότητες
- 2.1 Φυσικές ιδιότητες
- 2.2 Χημικές ιδιότητες
- 3 Χρήσεις και εφαρμογές
- 3.1 Σε υπερκαταναλωτές
- 3.2 Σε δευτερεύουσες μπαταρίες λιθίου
- 4 Κίνδυνοι
- 4.1 Διαδικασία πρώτων βοηθειών
- 4.2 Μέτρα πυρόσβεσης
- 5 Αναφορές
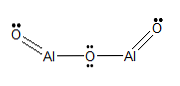
Χημική δομή
Μοριακός τύπος
Αλ2S3
Δομικός τύπος
- Σουλφίδιο αργιλίου.
- Τρισουλφίδιο αργιλίου.
- Το σουλφίδιο του αργιλίου (III).
- Σουλφίδιο αργιλίου.
Ιδιότητες
Οι χημικές ενώσεις παρουσιάζουν κυρίως δύο είδη ιδιοτήτων: φυσικές και χημικές.
Φυσικές ιδιότητες
Μοριακή μάζα
150,158 g / mol
Πυκνότητα
2,02 g / mL
Σημείο τήξης
1100 ° C
Υδατοδιαλυτότητα
Αδιάλυτο
Χημικές ιδιότητες
Μία από τις κύριες αντιδράσεις του θειούχου αλουμινίου είναι με νερό, ως υπόστρωμα ή κύριο αντιδραστήριο:

Αυτή η αντίδραση μπορεί να παρατηρηθεί ο σχηματισμός του υδροξειδίου του αλουμινίου και υδρόθειο εάν είναι σε μορφή αερίου, ή αν το υδρόθειο διαλύεται σε νερό ως διάλυμα. Η παρουσία του αναγνωρίζεται από τη μυρωδιά των σάπιων αυγών.
Χρήσεις και εφαρμογές
Σε υπερκαταναλωτές
θειούχο αργίλιο χρησιμοποιείται στην παρασκευή των δικτύων νανοδομών που ενισχύουν ειδικό εμβαδόν επιφανείας και ηλεκτρική αγωγιμότητα, έτσι ώστε να επιτευχθεί υψηλή χωρητικότητα και η πυκνότητα ενέργειας, η οποία είναι η δυνατότητα εφαρμογής της υπερπυκνωτές.
Το οξείδιο του γορφενίου (GO) - το γκρφένιο είναι μία από τις αλλοτροπικές μορφές άνθρακα - χρησίμευσε ως υπόστρωμα για το θειούχο αργίλιο (Al2S3) με ιεραρχική μορφολογία παρόμοια με εκείνη της νανο-montana που κατασκευάστηκε χρησιμοποιώντας την υδροθερμική μέθοδο.
Δράση οξειδίου του γραφένιου
Τα χαρακτηριστικά του οξειδίου του γραφενίου ως υποστηρίγματος, καθώς και η υψηλή ηλεκτρική αγωγιμότητα και η επιφάνεια, καθιστούν το nanorambutant Al2S3 να είναι ηλεκτροχημικά δραστική.
Οι καμπύλες χωρητικότητας συγκεκριμένου CV με καλά καθορισμένες κορυφές οξειδοαναγωγής επιβεβαιώνουν την ψευδο-χωρητική συμπεριφορά των nanorambutans ΑΙ2S3 ιεραρχική, διατηρούμενη σε οξείδιο του γραφένιου σε ηλεκτρολύτη 1Μ ΝαΟΗ. Οι συγκεκριμένες τιμές χωρητικότητας CV που λαμβάνονται από τις καμπύλες είναι: 168,97 με ταχύτητα σάρωσης 5mV / s.
Περαιτέρω, υπήρξε ένας χρόνος εκφόρτισης καλή γαλβανοστατική 903 μικροδευτερόλεπτα, ένας μεγάλος ειδική χωρητικότητα του 2178,16 στην πυκνότητα ρεύματος 3 mA / Cm2. Η ενεργειακή πυκνότητα που υπολογίζεται από την ηλεκτροστατική εκφόρτιση είναι 108,91 Wh / kg, με πυκνότητα ρεύματος 3 mA / Cm2.
Η ηλεκτροχημική αντίσταση επιβεβαιώνει έτσι την ψευδο-χωρητική φύση του ιεραρχικού νανοσυγχρονισμού ηλεκτροδίου Al2S3. Η δοκιμή σταθερότητας ηλεκτροδίων δείχνει μια διατήρηση 57,44% της συγκεκριμένης χωρητικότητας μέχρι 1000 κύκλους.
Τα πειραματικά αποτελέσματα υποδηλώνουν ότι το nanorambutant Al2S3 Η ιεραρχική είναι κατάλληλη για εφαρμογές υπερκαταναλωτών.
Σε δευτερεύουσες μπαταρίες λιθίου
Με σκοπό την ανάπτυξη δευτερεύουσας μπαταρίας λιθίου με υψηλή ενεργειακή πυκνότητα, το θειούχο αργίλιο (Al2S3) ως ενεργό υλικό.
Η αρχική ικανότητα εκκένωσης μετρήθηκε από την Al2S3 ήταν περίπου 1170 mAh g-1 στα 100 mA g-1. Αυτό αντιστοιχεί στο 62% της θεωρητικής ικανότητας για θείο.
Το Al2S3 παρουσίασε κακή κατακράτηση ικανότητας στην πιθανή περιοχή μεταξύ 0,01 V και 2,0 V, κυρίως λόγω της δομικής μη αναστρεψιμότητας της διαδικασίας φόρτισης ή της εκχύλισης Li..
Οι αναλύσεις XRD και K-XANES για αλουμίνιο και θείο έδειξαν ότι η επιφάνεια του Al2S3 αντιδρά αντίστροφα κατά τη διάρκεια των διαδικασιών φόρτωσης και εκφόρτωσης, ενώ ο πυρήνας Al2S3 έδειξε δομική μη αναστρεψιμότητα, επειδή LiAl και Li2S σχηματίστηκαν από την ΑΙ2S3 στην αρχική λήψη και στη συνέχεια παρέμειναν όπως ήταν.
Κίνδυνοι
- Σε επαφή με το νερό απελευθερώνει εύφλεκτα αέρια που μπορούν να καούν αυθόρμητα.
- Προκαλεί ερεθισμό του δέρματος.
- Προκαλεί σοβαρό οφθαλμικό ερεθισμό.
- Μπορεί να προκαλέσει ερεθισμό του αναπνευστικού συστήματος.
Οι πληροφορίες μπορεί να διαφέρουν μεταξύ των ειδοποιήσεων ανάλογα με τις προσμείξεις, τα πρόσθετα και άλλους παράγοντες.
Διαδικασία πρώτων βοηθειών
Γενική θεραπεία
Ζητήστε ιατρική βοήθεια εάν τα συμπτώματα επιμένουν.
Ειδική θεραπεία
Δεν υπάρχει
Σημαντικά συμπτώματα
Δεν υπάρχει
Εισπνοή
Πάρτε το θύμα σε εξωτερικούς χώρους. Παροχή οξυγόνου εάν η αναπνοή είναι δύσκολη.
Κατάποση
Χορηγήστε ένα ή δύο ποτήρια νερό και προκαλέστε εμετό. Ποτέ μην προκαλείτε εμετό ή δεν δίνετε τίποτα από το στόμα σε άτομο που έχει χάσει τις αισθήσεις του.
Δέρμα
Πλύνετε την πληγείσα περιοχή με νερό και ήπιο σαπούνι. Αφαιρέστε τα μολυσμένα ρούχα.
Μάτια
Πλύνετε τα μάτια σας με νερό, αναβοσβήνοντας συχνά για αρκετά λεπτά. Αφαιρέστε τους φακούς επαφής, εάν υπάρχουν, και συνεχίστε να ξεπλένετε.
Μέτρα πυρόσβεσης
Αναφλεξιμότητα
Δεν είναι εύφλεκτο.
Μέσα πυρόσβεσης
Αντιδρά με το νερό. Μην χρησιμοποιείτε νερό: χρησιμοποιήστε CO2, άμμο και πυροσβεστική σκόνη.
Διαδικασία καταπολέμησης
Χρησιμοποιήστε πλήρη αυτοδύναμη αναπνευστική συσκευή με πλήρη προστασία. Να φοράτε ρούχα για να αποφύγετε την επαφή με το δέρμα και τα μάτια.
Αναφορές
- Salud y Riesgos.com, (s.f), Ορισμός, έννοιες και άρθρα σχετικά με την υγεία, τους κινδύνους και το περιβάλλον. Ανάκτηση: saludyriesgos.com
- Σουλφίδιο αργιλίου. (s.f) Στο Wikiwand. Ανακτήθηκε στις 9 Μαρτίου 2018: wikiwand.com
- Στοιχεία ιστού (S.f) .Διαλυβινικό Trisulpfide, ανακτημένο στις 10 Μαρτίου 2018: webelements.com
- Iqbal, Μ., Hassan, Μ., Μ., Bibi S., Parveen, Β. (2017). Υψηλή ειδική χωρητικότητα και πυκνότητα ενέργειας της συνθετικής οξειδίου του γραφένιου με βάση την ιεραρχική Al2S3 Nanorambutan για την εφαρμογή υπερκαταναλωτών, Electrochimica Acta, Τόμος 246 ,Σελίδες 1097-1103
- Senoh, Η., Takeuchi, Τ., Hiroyuki Κ., Sakaebe, Η., Μ., Nakanishi, Κ., Ohta, Τ., Sakai, Τ., Yasuda, Κ. (2010). Ηλεκτροχημικά χαρακτηριστικά του θειούχου αργιλίου για χρήση στο λίθιο.Εφημερίδα των πηγών ενέργειας,Τόμος 195, Τεύχος 24, Σελίδες 8327-8330 doi.org
- LTS Research Laboratories, Inc (2016), Δελτίο Δεδομένων Ασφαλείας Σουλφίδιο αργιλίου: ltschem.com