Σύνθεση θειικού αργιλίου (Al2 (SO4) 3), χρήσεις, τύποι, τοξικότητα
Το θειικό αργίλιο είναι ένα ανόργανο άλας αργιλίου του τύπου ΑΙ2(SO4)3, που συνήθως εμφανίζεται ως λευκό στερεό με γυαλιστερά κρύσταλλα. Το χρώμα της ένωσης θα επηρεαστεί από τη συγκέντρωση του σιδήρου και κάθε άλλη ακαθαρσία. Υπάρχουν δύο κύριοι τύποι θειικού αργιλίου: Α και Β.
Στην κάτω εικόνα εμφανίζονται λευκοί κρύσταλλοι ενυδατωμένου θειικού αργιλίου. Η απουσία καφέ χρωματισμών, ενδεικτική των ιόντων σιδήρου μέσα στο κρυσταλλικό πλέγμα, μπορεί να σημειωθεί.

Το θειικό αργίλιο είναι ένα άλας το οποίο είναι πολύ διαλυτό στο νερό και στη φύση είναι σπάνιο να το βρούμε στην άνυδρη μορφή του. Συνήθως ενυδατώνεται με τη μορφή θειικού αλουμινίου δεκαοκταϋδριδίου [Al2(SO4)3.18Η2O] ή εξαδεκαϋδρίτης [Al2(SO4)3.16Η2O].
Ομοίως, μπορεί να σχηματίσει διπλά άλατα με κάλιο, και με αμμώνιο, ενώσεις γνωστές ως στυπτηρία. Εν μέρει αυτό μπορεί να οφείλεται στη συγγένεια του νερού μέσα στα ένυδρα άλατα για τη συγκράτηση άλλων ιόντων εκτός από το αλουμίνιο.
Το θειικό αργίλιο μπορεί να αποσυντεθεί με τη δράση του νερού σε υδροξείδιο αργιλίου και θειικό οξύ. Αυτή η ιδιότητα επέτρεψε τη χρήση του ως όξινο παράγοντα των εδαφών.
Είναι επίσης μια τοξική ένωση, ειδικά με επαφή με τη σκόνη της. Ωστόσο, έχει ένα άπειρο χρήσεις και εφαρμογές που πηγαίνουν από τον καθαρισμό του νερού με τη μέθοδο της πήξης, που συμβαίνει μέσω της χρήσης του σε διάφορες βιομηχανίες, μέχρι τη χρήση του με θεραπευτικούς σκοπούς.
Ευρετήριο
- 1 Δομή
- 2 Τι είναι το (χρήσεις)
- 2.1 Συσσωμάτωση ή κροκύδωση νερού
- 2.2 Χρήση ως μελανιού των μελανιών και στην επεξεργασία χαρτιού
- 2.3 Βιομηχανικές χρήσεις
- 2.4 Φαρμακευτικές και θεραπευτικές χρήσεις
- 2.5 Άλλες χρήσεις
- 3 Παραγωγή θειικού αργιλίου
- 4 Τύποι
- 5 Τοξικότητα
- 6 Αναφορές
Δομή
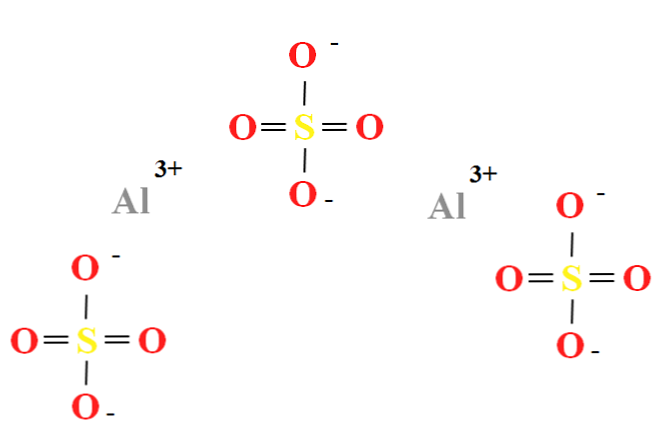
Το θειικό αργίλιο έχει αναλογία δύο αλκαλικών κατιόντων3+ για κάθε τρία ανιόντα SO42- (κορυφαία εικόνα), η οποία μπορεί να παρατηρηθεί απευθείας στον χημικό τύπο Al2(SO4)3.
Σημειώστε ότι το Al3+ είναι γκριζωπό, ενώ το SO42- είναι κίτρινα (για το άτομο θείου) και κόκκινο (για τα άτομα οξυγόνου).
Η απεικονιζόμενη δομή αντιστοιχεί στην άνυδρη μορφή του ΑΙ2(SO4)3, καθώς κανένα μόριο νερού δεν αλληλεπιδρά με τα ιόντα. Εντούτοις, στα ένυδρα σας, το νερό μπορεί να προσελκύσει τα θετικά κέντρα του Al3+, ή από το αρνητικό SO tetrahedra42- μέσω δεσμών υδρογόνου (HOH-O-SO32-).
Το Al2(SO4)3∙ 18Η2Ή, για παράδειγμα, περιέχει 18 μόρια νερού στη στερεά δομή του. Ορισμένες από αυτές μπορεί να βρίσκονται σε άμεση επαφή με τον Αλ3+ ή με την ΑΑ42-. Με άλλα λόγια: το θειικό αργίλιο μπορεί να έχει εσωτερικό ή εξωτερικό νερό συντονισμού.
Επίσης, η δομή του μπορεί να φιλοξενήσει και άλλα κατιόντα όπως το Fe3+, Na+, Κ+, κ.λπ. Για το λόγο αυτό είναι απαραίτητο να υπάρχουν περισσότερα ανιόντα SO42-. Γιατί; Να εξουδετερωθεί η αύξηση των θετικών φορτίων λόγω μεταλλικών ακαθαρσιών.
Το θειικό αργίλιο μπορεί να έχει πολλές δομές, αν και οι ένυδρες μορφές του τείνουν να υιοθετούν το μονοκλινικό κρυσταλλικό σύστημα.
Φυσικές και χημικές ιδιότητες
Εμφάνιση
Εμφανίζεται ως ένα στερεό με λαμπερά λευκά κρύσταλλα, κόκκους ή σκόνη.
Μοριακό βάρος
342,31 g / mol (άνυδρο).
Οσμή
Είναι άοσμο
Γεύση
Γλυκό γεύση μέτρια στυπτικό.
Σημείο τήξης
770 ° C άνυδρη μορφή (86,5 ° C μορφή οκταδεκαδραζιδάδας)
Διαλυτότητα στο νερό
31,2 g / 100 ml στους 0 ° C. 36,4 g / 100 ml στους 20 ° C και 89 g / 100 ml στους 100 ° C.
Πυκνότητα
2,67 έως 2,71 g / cm3.
Διαλυτότητα
Ελαφρώς διαλυτό σε αιθυλική αλκοόλη.
Πίεση ατμού
Ουσιαστικά μηδέν.
Σταθερότητα
Σταθερό στον αέρα.
Αποσύνθεση
Όταν θερμαίνεται, περίπου στο σημείο τήξης του, μπορεί να αποσυντεθεί εκπέμποντας ιδιαίτερα το οξείδιο του θείου, ένα τοξικό αέριο.
Διαβρωτικότητα
Τα διαλύματα θειικού αργιλίου είναι διαβρωτικά για το αλουμίνιο. Επίσης, η ένωση μπορεί να διαβρώσει μέταλλα παρουσία υγρασίας.
pKa
3.3 έως 3.6. Και το ρΗ του είναι 2.9 ή περισσότερο σε ένα υδατικό διάλυμα 5%.
Τι είναι για (χρήσεις)
Πήξη ή κροκύδωση νερού
-Όταν αναμιγνύεται με νερό (πόσιμο, που εξυπηρετούνται ή απόβλητα), θειικό αργίλιο προέρχεται υδροξείδιο του αργιλίου, το οποίο σχηματίζει σύμπλοκο με τις ενώσεις και τα σωματίδια σε διάλυμα επιταχύνει καθίζησης, το οποίο εν απουσία της θεραπείας με θειικό αργίλιο λάβει μακρύς.
-Το θειικό αργίλιο χρησιμοποιείται επίσης για τον καθαρισμό του νερού της πισίνας, καθιστώντας τα πιο ελκυστικά για χρήση.
-Μέσω της χρήσης θειικού αργιλίου, το νερό αποκτάται χωρίς θολότητα και χρώμα, αυξάνοντας την ικανότητα του πόσιμου νερού διευκολύνοντας τον καθαρισμό του νερού. Δυστυχώς αυτή η μέθοδος καθαρισμού μπορεί να οδηγήσει σε ελαφρά αυξημένη συγκέντρωση αλουμινίου στο νερό.
-Το αργίλιο είναι ένα πολύ τοξικό μέταλλο που συσσωρεύεται στο δέρμα, στον εγκέφαλο και στους πνεύμονες, προκαλώντας σοβαρές διαταραχές. Επιπλέον, δεν είναι γνωστό ποια λειτουργία εκπληρώνει στα ζωντανά όντα.
-Η Ευρωπαϊκή Ένωση απαιτεί το μέγιστο επιτρεπτό όριο αλουμινίου στο νερό να μην υπερβαίνει τα 0,2 mg / l. Εν τω μεταξύ, η Αμερικανική Υπηρεσία Περιβαλλοντικής Προστασίας απαιτεί το μέγιστο όριο μόλυνσης με αλουμίνιο να μην υπερβαίνει τα 0,05-0,2 mg / l.
-Η επεξεργασία των λυμάτων ή η χρήση με θειικό αργίλιο επιτρέπει την οικονομική εξάλειψη ή μείωση του φωσφόρου σε αυτά.
Χρήση ως μεσολαβητής των μελανιών και στην επεξεργασία χαρτιού
-Το θειικό άλας αλουμινίου έχει χρησιμοποιηθεί ως βαφή για βαφές ή μελάνια, βοηθώντας να στερεωθεί στο υλικό που πρόκειται να βαφεί. Η δράση στερέωσης οφείλεται σε Al (OH)3, της οποίας η ζελατινώδης σύσταση συμβάλλει στην προσρόφηση χρωστικών ουσιών στα υφάσματα.
-Αν και έχει χρησιμοποιηθεί από το 2000 π.Χ. για τον περιγραφόμενο σκοπό, μόνο οι οργανικές βαφές απαιτούν βακτηρίδια. Οι συνθετικές χρωστικές ουσίες, από την άλλη πλευρά, δεν απαιτούν τα βακτήρια να εκπληρώσουν τη λειτουργία τους.
-Έχει εκτοπιστεί από την παραγωγή χαρτιού, αλλά εξακολουθεί να χρησιμοποιείται στην παραγωγή χαρτοπολτού. Αφαιρεί τις ακαθαρσίες, καθώς έχει χρησιμοποιηθεί για τη δέσμευση υλικών, την εξουδετέρωση των φορτίων και τη βαθμονόμηση του κολοφωνίου.
Βιομηχανικές χρήσεις
-Χρησιμοποιείται στην κατασκευαστική βιομηχανία για να επιταχύνει τη ρύθμιση του σκυροδέματος. Επιπλέον, χρησιμοποιείται για τη στεγάνωση των κτιρίων.
-Στη βιομηχανία σαπουνιών και λιπών, χρησιμοποιείται στην παραγωγή γλυκερίνης.
-Χρησιμοποιείται στη βιομηχανία πετρελαίου για την κατασκευή συνθετικών καταλυτών που χρησιμοποιούνται κατά τη λειτουργία.
-Χρησιμοποιείται στη φαρμακευτική βιομηχανία ως στυπτικό στην παρασκευή φαρμάκων και καλλυντικών.
-Παρεμβαίνει στην παραγωγή βαφών όπως καρμίνη. Χρησιμοποιείται επίσης ως βαφή για την κατασκευή συνθετικών καουτσούκ βουταδιενίου στυρολίου.
-Στην βιομηχανία παραγωγής ζάχαρης χρησιμοποιείται ως καθαριστής μελάσας για ζαχαροκάλαμο.
-Χρησιμοποιείται στην κατασκευή αποσμητικών. Γιατί; Επειδή προκαλεί στένωση των αγωγών των αδένων sudoríperas, περιορίζοντας έτσι την συσσώρευση του ιδρώτα, μέσα που είναι αναγκαία για την ανάπτυξη των βακτηρίων που προκαλούν άσχημη μυρωδιά.
-Χρησιμοποιείται στην δερματική δερματίνη, την απαραίτητη διαδικασία για τη χρήση της. Επιπλέον, χρησιμοποιείται στην παρασκευή λιπασμάτων.
-Χρησιμοποιείται ως πρόσθετο στην παρασκευή χρωμάτων, συγκολλητικών και στεγανωτικών, καθώς και προϊόντων καθαρισμού και φροντίδας για έπιπλα..
Φαρμακευτικές και θεραπευτικές χρήσεις
-Το θειικό αργίλιο είναι ανοσολογικό ανοσοενισχυτικό. Επομένως, εκπληρώνει τη λειτουργία της επεξεργασίας των αντιγόνων με τέτοιο τρόπο ώστε, όταν απελευθερώνονται στη θέση δράσης τους, να παράγουν μεγαλύτερη παραγωγή αντισωμάτων για τα αντιγόνα που εμβολιάστηκαν.
-ανοσοενισχυτικό Freund και BCG, και άλλα πρόσθετα, συμπεριλαμβανομένων των ενδογενών και ιντερλευκίνες, είναι μη ειδική για αντιγόνα, επιτρέποντας αυξημένη ακτίνα ανοσοποιητικού δράσης. Αυτό επέτρεψε την ανάπτυξη πολλών ασθενειών εμβόλια μειονεκτήματα.
-Η δράση πήξης του θειικού αργιλίου επέτρεψε την εξάλειψη πολυάριθμων ιών στο επεξεργασμένο νερό, μεταξύ άλλων: Q beta, MS2, T4 και P1. Τα αποτελέσματα δείχνουν ότι η επεξεργασία του νερού με θειικό αργίλιο προκαλεί απενεργοποίηση τέτοιων ιών.
-Το θειικό αργίλιο χρησιμοποιείται υπό μορφή ραβδίου ή ως σκόνη για τη θεραπεία μικρών επιφανειακών πληγών ή εκδορών που παράγονται κατά το ξύρισμα.
-Χρησιμοποιείται στην παρασκευή οξικού αλουμινίου, μιας ένωσης που χρησιμοποιείται στη θεραπεία ορισμένων συνθηκών στο αυτί. Έχει επίσης χρησιμοποιηθεί, χωρίς σημαντική επιτυχία, για να ανακουφίσει τις συνέπειες των τσιμπήματος των μυρμηγκιών..
-Διαλύματα θειικού αργιλίου χρησιμοποιούνται, σε συγκέντρωση 5% έως 10%, στην τοπική θεραπεία των ελκών που επιτρέπουν τον έλεγχο των εκκρίσεων τους.
-Η στυπτική δράση του θειικού αργιλίου συστέλλει τα επιφανειακά στρώματα του δέρματος, συσσωματώντας τις πρωτεΐνες και θεραπεύοντας τις πληγές.
Άλλες χρήσεις
-Το θειικό αργίλιο βοηθά στον έλεγχο της υπερβολικής ανάπτυξης των φυκών σε λίμνες, λίμνες και σε ρέματα νερού. Χρησιμοποιείται επίσης για την απομάκρυνση των μαλακίων, μεταξύ άλλων και του ισπανικού γυμνοσάλιαγκας.
-Οι κηπουροί εφαρμόζουν αυτή την ένωση για την οξίνιση αλκαλικών εδαφών. Σε επαφή με το νερό αυτού, το θειικό αργίλιο αποσυντίθεται σε υδροξείδιο αργιλίου και αραιό θειικό οξύ. Κατόπιν, το υδροξείδιο του αλουμινίου καθιζάνει, αφήνοντας το θειικό οξύ σε διάλυμα.
-Η οξίνιση των εδαφών λόγω του θειικού οξέος απεικονίζεται με πολύ δημιουργικό τρόπο, λόγω της ύπαρξης ενός φυτού που ονομάζεται Ορτανσία, τα λουλούδια του οποίου γίνονται μπλε παρουσία όξινου εδάφους. δηλαδή, είναι ευαίσθητα και ανταποκρίνονται σε αλλαγές στο pH.
-Το θειικό αργίλιο εμπλέκεται στην παραγωγή αφρού για την καταπολέμηση και τον έλεγχο της φωτιάς. Πώς; Αντιδρά με διττανθρακικό νάτριο, παράγοντας την απελευθέρωση του CO2. Αυτό το αέριο μπλοκάρει την πρόσβαση Ο2 προς τη θέση καύσης του υλικού. και κατά συνέπεια την κατάπαυση του πυρός που αναπτύχθηκε.
Παραγωγή θειικού αργιλίου
Το θειικό αργίλιο συντίθεται με αντίδραση μιας πλούσιας σε αργίλιο ένωσης, όπως μετάλλου βωξίτη, με θειικό οξύ σε αυξημένες θερμοκρασίες. Η ακόλουθη χημική εξίσωση αντιπροσωπεύει την αντίδραση:
Αλ2Ο3 + H2Έτσι4 -> Al2(SO4)3 + 3 Η2Ο
Το θειικό αργίλιο μπορεί επίσης να σχηματιστεί με αντίδραση εξουδετέρωσης μεταξύ υδροξειδίου του αργιλίου και θειικού οξέος, σύμφωνα με την ακόλουθη αντίδραση:
2ΑΙ (ΟΗ)3 + 3 Η2Έτσι4 + 12 Η2O -> Al2(SO4)3.18Η2Ο
Το θειικό οξύ αντιδρά με αλουμίνιο για να σχηματίσει θειικό αμμώνιο και την απελευθέρωση μορίων υδρογόνου με τη μορφή αερίου. Η αντίδραση σχηματοποιείται ως εξής:
2 Al + 3 Η2Έτσι4 -> Al2(SO4)3 + 3 Η2
Τύποι
Το θειικό αργίλιο κατατάσσεται σε δύο τύπους: τύπου Α και τύπου Β. Σε θειικό αργίλιο τύπου Α, τα στερεά είναι λευκά και έχουν συγκέντρωση σιδήρου μικρότερη από 0,5%.
Σε θειικό αργίλιο τύπου Β, τα στερεά είναι καφέ και έχουν συγκέντρωση σιδήρου μικρότερη από 1,5%.
Υπάρχουν βιομηχανίες παραγωγής θειικού αργιλίου που έχουν διαφορετικά κριτήρια για την ταξινόμησή τους. Έτσι, ένας κλάδος αναφέρει για την παρασκευή του θειικού αργύρου τύπου Α μέγιστη συγκέντρωση 0,1% σιδήρου ως οξείδιο του σιδήρου. Ενώ για τον τύπο Β δείχνουν μέγιστη συγκέντρωση σιδήρου 0,35%.
Τοξικότητα
-θειικό αργίλιο είναι μία ένωση η οποία εξασκεί τοξική επίδραση της με την επαφή με σκόνη, προκαλώντας έτσι ερεθισμό του δέρματος, καθώς και στις περιπτώσεις ότι η επαφή είναι συχνή, δερματίτιδα.
-Στα μάτια προκαλεί έντονο ερεθισμό, ακόμη και για την πρόκληση μόνιμων τραυματισμών.
-Η εισπνοή προκαλεί ερεθισμό της μύτης και του λαιμού, γεγονός που μπορεί να προκαλέσει βήχα και εξανθήματα.
-Η πρόσληψη προκαλεί γαστρικό ερεθισμό, ναυτία και έμετο.
-Υπάρχουν τοξικές επιπτώσεις που, αν και δεν οφείλονται άμεσα στο θειικό αργίλιο, οφείλονται έμμεσα στη χρήση τους. Αυτό συμβαίνει με ορισμένες τοξικές επιδράσεις του αλουμινίου, που προκαλούνται από τη χρήση θειικού αργιλίου στον καθαρισμό του νερού.
-Οι ασθενείς που υποβάλλονται σε χρόνια διάλυση με τη χρήση αλάτων που παρασκευάζονται σε καθαρό νερό, μέσω της χρήσης θειικού αργιλίου, εμφανίζουν πολύ σοβαρές διαταραχές της υγείας. Μεταξύ αυτών των διαταραχών έχουμε αναιμία, άνοια με αιμοκάθαρση και αύξηση των ασθενειών των οστών.
Αναφορές
- Wikipedia. (2018). Θειικό αργίλιο Λαμβάνεται από: en.wikipedia.org
- Aris Industrial Διάλυμα θειικού αργιλίου τύπου Α και Β. Λαμβάνεται από: aris.com.pe
- Κρίστοφερ Μπόιντ (9 Ιουνίου 2014). Κορυφαίες βιομηχανικές χρήσεις για το θειικό αργίλιο. Λαμβάνεται από: chemservice.com
- PubChem. (2018). Ανύδρου θειικού αργιλίου. Από: pubchem.ncbi.nlm.nih.gov
- Andesia Chemicals (20 Αυγούστου 2009). Φύλλο ασφαλείας θειικού αργιλίου. [PDF] Λαμβάνεται από: andesia.com
- Chemical Book. (2017). Θειικό αργίλιο. Από: chembook.com


