Οργανικά άλατα φυσικές και χημικές ιδιότητες, χρήσεις και παραδείγματα
Το οργανικά άλατα είναι ένας πυκνός αριθμός ιοντικών ενώσεων με αναρίθμητα χαρακτηριστικά. Προέρχονται προηγουμένως από μια οργανική ένωση, η οποία έχει υποστεί μετασχηματισμό που της επιτρέπει να είναι φορέας φορτίου και ότι επίσης η χημική της ταυτότητα εξαρτάται από το σχετικό ιόν.
Στην παρακάτω εικόνα παρουσιάζονται δύο πολύ γενικές χημικές φόρμουλες για οργανικά άλατα. Το πρώτο, R-AX, ερμηνεύεται ως ένωση στην άνθρακα του οποίου ένα άτομο ή ομάδα Α φέρει θετικό φορτίο + ή αρνητικό (-).
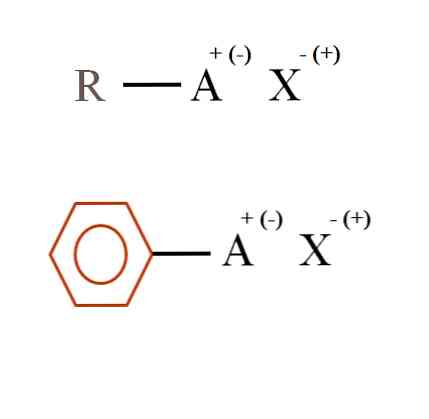
Όπως φαίνεται, υπάρχει ένας ομοιοπολικός δεσμός μεταξύ R και Α, R-Α, αλλά με τη σειρά, Α έχει ένα τυπικό φορτίο που προσελκύει (ή απωθεί) το ιόν X. Το πρόσημο του φορτίου εξαρτάται από τη φύση των Α και το χημικό περιβάλλον.
Εάν ο Α ήταν θετικός, πόσοι X μπορούσαν να αλληλεπιδράσουν με αυτόν; Με μόνο ένα, δεδομένης της αρχής της ηλεκτροναυτικότητας (+ 1-1 = 0). Ωστόσο, ποια είναι η ταυτότητα του Χ; Το ανιόν Χ μπορεί να είναι το CO32-, απαιτώντας δύο κατιόντα RA+? ένα αλογόνο: F-, Cl-, Br-, κ.λπ. ή ακόμη, μια άλλη ένωση ΡΑ-. Οι επιλογές είναι ανυπολόγιστες.
Επίσης, ένα οργανικό άλας μπορεί να έχει έναν αρωματικό χαρακτήρα, που απεικονίζεται στον καφέ βενζολικό δακτύλιο. Το βενζοϊκό άλας χαλκού (II), (C6H5COO)2Το Cu, για παράδειγμα, αποτελείται από δύο αρωματικούς δακτυλίους με αρνητικά φορτισμένες καρβοξυλικές ομάδες, οι οποίες αλληλεπιδρούν με το Cu κατιόν.2+.
Ευρετήριο
- 1 Φυσικές και χημικές ιδιότητες
- 1.1 Υψηλές μοριακές μάζες
- 1.2 Αμφιφίλοι και επιφανειοδραστικές ουσίες
- 1.3 Υψηλά σημεία βρασμού ή τήξης
- 1.4 Οξύτητα και βασικότητα
- 2 Χρήσεις
- 3 Παραδείγματα οργανικών αλάτων
- 3.1. Καρβοξυλικά
- 3.2 Διακρυλικές ενώσεις λιθίου
- 3.3 Αλάτια του σουλφονίου
- 3.4 Άλατα του οξονίου
- 3.5 Άλατα αμίνης
- 3.6 Άλατα διαζωνίου
- 4 Αναφορές
Φυσικές και χημικές ιδιότητες
Image μπορούμε να πούμε ότι τα οργανικά άλατα αποτελούνται από τρία συστατικά: η οργανική, R ή Ar (ο αρωματικός δακτύλιος), ένα άτομο ή ιόν χρέωση φορέα Μια ομάδα, και ένα αντισταθμιστικό ιόν Χ.
Ακριβώς όπως η χημική ταυτότητα και η δομή καθορίζονται από τέτοια συστατικά, έτσι οι ιδιότητές τους εξαρτώνται από αυτά.
Από αυτό μπορεί να συνοψιστούν ορισμένες γενικές ιδιότητες που πληρούν τη συντριπτική πλειοψηφία αυτών των αλάτων.
Υψηλές μοριακές μάζες
Υποθέτοντας μονο- ή πολυδύναμα ανόργανα ανιόντα Χ, τα οργανικά άλατα συνήθως έχουν πολύ μεγαλύτερες μοριακές μάζες από τα ανόργανα άλατα. Αυτό οφείλεται κυρίως στον σκελετό άνθρακα, των οποίων οι απλοί δεσμοί C-C και τα άτομα υδρογόνου τους συμβάλλουν πολύ στην μάζα.
Ως εκ τούτου, είναι R ή Ar υπεύθυνοι για τα υψηλά μοριακά βάρη τους.
Αμφιφίλοι και επιφανειοδραστικές ουσίες
Τα οργανικά άλατα είναι αμφίφιλες ενώσεις, δηλαδή, οι δομές τους έχουν τόσο υδρόφιλα όσο και υδρόφοβα άκρα.
Ποια είναι αυτά τα άκρα; R ή Ar αντιπροσωπεύουν το υδρόφοβο άκρο, επειδή τα άτομα C και Η δεν έχουν μεγάλη συγγένεια για μόρια νερού.
Α+(-), το άτομο ή η ομάδα που φέρει το φορτίο είναι το υδρόφιλο άκρο, καθώς συμβάλλει στη διπολική ροπή και αλληλεπιδρά με τα δίπολα σχηματισμού ύδατος (RA+ OH2).
Όταν οι υδρόφιλες και υδρόφοβες περιοχές πολώνονται, το αμφίφιλο άλας γίνεται επιφανειοδραστική ουσία, μια ουσία που χρησιμοποιείται ευρέως για την παρασκευή απορρυπαντικών και δηλητηριωτές.
Σημεία υψηλής ζέσεως ή τήξης
Όπως τα ανόργανα άλατα, τα οργανικά άλατα έχουν επίσης υψηλά σημεία τήξης και βρασμού, εξαιτίας των ηλεκτροστατικών δυνάμεων που διέπουν σε υγρή ή στερεή φάση.
Ωστόσο, έχει ένα οργανικό συστατικό R ή Ar, εμπλέκονται και άλλοι τύποι δύναμη Van der Waals (δυνάμεις Λονδίνο, διπόλου-διπόλου, δεσμών υδρογόνου) που ανταγωνίζονται με έναν ορισμένο τρόπο με ηλεκτροστατική.
Για το λόγο αυτό, οι στερεές ή υγρές δομές των οργανικών αλάτων είναι, κατά πρώτο λόγο, πιο πολύπλοκες και ποικίλες. Κάποιοι από αυτούς μπορεί να συμπεριφέρονται ακόμη και σαν υγρούς κρυστάλλους.
Οξύτητα και βασικότητα
Τα οργανικά άλατα είναι συνήθως ισχυρότερα οξέα ή βάσεις από τα ανόργανα άλατα. Αυτό συμβαίνει επειδή το Α, για παράδειγμα στα άλατα αμίνης, έχει θετικό φορτίο λόγω του δεσμού του με ένα επιπλέον υδρογόνο: Α+-Η. Στη συνέχεια, σε επαφή με μια βάση, δώστε το πρωτόνιο να επιστρέψει σε μια ουδέτερη ένωση:
RA+Η + Β => ΡΑ + ΗΒ
Το Η ανήκει στον Α, αλλά είναι γραμμένο καθώς παρεμβαίνει στην αντίδραση εξουδετέρωσης.
Από την άλλη πλευρά, η RA+ μπορεί να είναι ένα μεγάλο μόριο, ανίκανο να σχηματίσει στερεά με ένα κρυσταλλικό δίκτυο επαρκώς σταθερό με το υδροξύλ ή το υδροξύλιο ΟΗ-.
Όταν συμβαίνει αυτό, αλάτι RA+OH- συμπεριφέρεται σαν μια ισχυρή βάση. ακόμη και ως βασικό ως NaOH ή ΚΟΗ:
RA+OH- + ΗΟΙ => RACI + Η2Ο
Παρατηρήστε στη χημική εξίσωση ότι το ανιόν Cl- αντικαθιστά το OH-, σχηματίζοντας το άλας RA+Cl-.
Χρησιμοποιεί
Η χρήση οργανικών αλάτων ποικίλλουν ανάλογα με την ταυτότητα του R, Ar, Α και Χ Επιπλέον, η εφαρμογή που προορίζονται επίσης εξαρτάται από τον τύπο του στερεού ή υγρού σχηματισμού. Ορισμένες γενικότητες είναι:
-Χρησιμεύουν ως αντιδραστήρια για τη σύνθεση άλλων οργανικών ενώσεων. Το RAX μπορεί να δρα ως "δότης" της αλυσίδας R που πρόκειται να προστεθεί σε μια άλλη ένωση που αντικαθιστά μια καλή ομάδα εξερχόμενων.
-Είναι επιφανειοδραστικές ουσίες, επομένως μπορούν επίσης να χρησιμοποιηθούν ως λιπαντικά. Για το σκοπό αυτό χρησιμοποιούνται μεταλλικά άλατα καρβοξυλικών.
-Επιτρέπουν τη σύνθεση μιας ευρείας γκάμας βαφών.
Παραδείγματα οργανικών αλάτων
Καρβοξυλικά
Τα καρβοξυλικά οξέα αντιδρούν με υδροξείδιο σε αντίδραση εξουδετέρωσης, δημιουργώντας άλατα καρβοξυλικών: RCOO- Μ+? όπου M+ Μπορεί να είναι οποιοδήποτε μεταλλικό κατιόν (Na+, Pb2+, Κ+, κ.λπ.) ή το κατιόν αμμωνίου ΝΗ4+.
Τα λιπαρά οξέα είναι αλειφατικά καρβοξυλικά οξέα μακράς αλυσίδας, μπορούν να είναι κορεσμένα και ακόρεστα. Το παλμιτικό οξύ (CH) είναι μεταξύ των κορεσμένων3(CH2)14COOH). Αυτό προέρχεται από παλμιτικό άλας, ενώ το στεατικό οξύ (CH3(CH2)16Το COOH σχηματίζει το στεατικό άλας. Τα σαπούνια αποτελούνται από αυτά τα άλατα.
Στην περίπτωση βενζοϊκού οξέος,6H5COOH (όπου C6H5- είναι ένας δακτύλιος βενζολίου), όταν αντιδρά με μια βάση σχηματίζει τα βενζοϊκά άλατα. Σε όλα τα καρβοξυλικά, η ομάδα -COO- αντιπροσωπεύει Α (ΡΑΧ).
Διασκοπικά λιθίου
Το διοξείδιο του λιθίου είναι χρήσιμο στην οργανική σύνθεση. Ο τύπος του είναι [R-Cu-R]-Λι+, στην οποία το άτομο χαλκού φέρει αρνητικό φορτίο. Εδώ, ο χαλκός αντιπροσωπεύει το άτομο Α της εικόνας.
Άλατα σουλφονίου
Αυτά σχηματίζονται από την αντίδραση ενός οργανικού σουλφιδίου με ένα αλκυλαλογονίδιο:
R2S + R'X => R2R'S+Χ
Για αυτά τα άλατα, το άτομο θείου φέρει ένα θετικό επίσημο φορτίο (S.+) που έχει τρεις ομοιοπολικούς δεσμούς.
Οξονιακά άλατα
Επίσης, οι αιθέρες (τα οξυγονωμένα ανάλογα των σουλφιδίων) αντιδρούν με τα υδροξείδια για να σχηματίσουν τα άλατα οξονίου:
ROR '+ HBr <=> RO+HR '+ Br-
Το όξινο πρωτόνιο του HBr συνδέεται ομοιοπολικά με το άτομο οξυγόνου του αιθέρα (R2Ο+-H), το φορτώνει θετικά.
Άλατα αμίνης
Οι αμίνες μπορούν να είναι πρωτοταγείς, δευτεροταγείς, τριτοταγείς ή τεταρτογενείς, καθώς και τα άλατά τους. Όλα αυτά χαρακτηρίζονται από το ότι έχουν ένα άτομο Η συνδεδεμένο με το άτομο αζώτου.
Έτσι, RNH3+Χ- είναι ένα πρωτογενές άλας αμίνης. R2NH2+Χ-, δευτεροταγούς αμίνης. R3NH+Χ-, της τριτοταγούς αμίνης. και R4Ν+Χ-, της τεταρτοταγούς αμίνης (άλας τεταρτοταγούς αμμωνίου).
Άλατα διαζωνίου
Τέλος, τα άλατα διαζωνίου (RN2+Χ-) ή αριλδιαζόνιο (ArN)2+Χ-), αντιπροσωπεύουν το σημείο εκκίνησης για πολλές οργανικές ενώσεις, ιδιαίτερα αζωχρώματα.
Αναφορές
- Francis A. Carey. Οργανική Χημεία (Έκτη έκδοση, σελ. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig Β. Fryhle. Οργανική Χημεία. Αμίνες (10η έκδοση). Wiley Plus.
- Wikipedia. (2018). Αλάτι (Χημεία). Λαμβάνεται από: en.wikipedia.org
- Steven A. Hardinger. (2017). Εικονογραφημένο Γλωσσάριο Οργανικής Χημείας: άλατα. Ανακτήθηκε από: chem.ucla.edu
- Chevron Oronite. (2011). Καρβοξυλικά. [PDF] Ανακτήθηκε από: oronite.com


