Τι είναι ένα κορεσμένο διάλυμα; (με παραδείγματα)
Ένα κορεσμένο διάλυμα είναι μια χημική λύση που περιέχει τη μέγιστη συγκέντρωση διαλελυμένης ουσίας που διαλύεται σε διαλύτη. Θεωρείται μια κατάσταση δυναμικής ισορροπίας όπου οι ταχύτητες με τις οποίες ο διαλύτης διαλύει τη διαλελυμένη ουσία και ο ρυθμός ανακρυστάλλωσης είναι ίσοι (J., 2014).
Η πρόσθετη διαλυμένη ουσία δεν θα διαλυθεί σε ένα κορεσμένο διάλυμα και εμφανίζονται σε ένα ξεχωριστό στάδιο, είτε ένα ίζημα εάν ένα στερεό σε υγρό ή αναβρασμό όταν ένα αέριο σε ένα υγρό (Anne Marie Helmenstine, 2016).
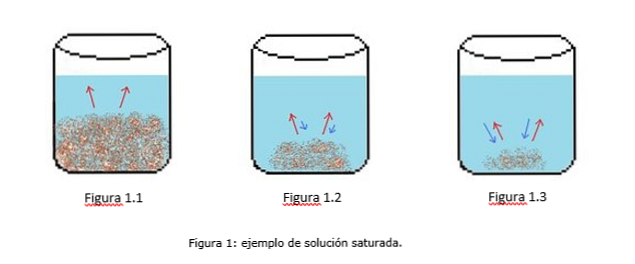
Ένα παράδειγμα κεκορεσμένου διαλύματος απεικονίζεται στο σχήμα 1. Στο Σχήμα 1.1, 1.2 και 1.3 υπάρχει σταθερός όγκος νερού στο ποτήρι. Στο σχήμα 1.1 αρχίζει η διαδικασία κορεσμού, όπου η διαλυμένη ουσία αρχίζει να διαλύεται, που αντιπροσωπεύεται από τα κόκκινα βέλη.
Στο σχήμα 1.2, μεγάλο μέρος του στερεού έχει διαλυθεί, αλλά όχι εντελώς λόγω της διαδικασίας ανακρυστάλλωσης, που αντιπροσωπεύεται από τα μπλε βέλη.
Στο Σχήμα 1.3, μόνο μια μικρή ποσότητα διαλελυμένης ουσίας παραμένει αδιάλυτη. Σε αυτή την περίπτωση, ο ρυθμός ανακρυστάλλωσης είναι μεγαλύτερος από τον ρυθμό διάλυσης. (αιχμές κορεσμού, 2014)
Το σημείο της μέγιστης συγκέντρωσης μιας διαλελυμένης ουσίας σε ένα διαλύτη είναι γνωστό ως σημείο κορεσμού.
Ευρετήριο
- 1 Παράγοντες που επηρεάζουν τον κορεσμό
- 1.1 Θερμοκρασία
- 1.2 Πίεση
- 1.3 Χημική σύνθεση
- 1.4 Μηχανικοί παράγοντες
- 2 Καμπύλες κορεσμού και διαλυτότητας
- 3 Παραδείγματα κορεσμένων διαλυμάτων
- 4 Τι είναι μια υπερκορεσμένη λύση?
- 5 Αναφορές
Παράγοντες που επηρεάζουν τον κορεσμό
Η ποσότητα της διαλελυμένης ουσίας που μπορεί να διαλυθεί σε ένα διαλύτη θα εξαρτηθεί από διάφορους παράγοντες, μεταξύ των οποίων οι σημαντικότεροι είναι:
Θερμοκρασία
Η διαλυτότητα αυξάνεται με τη θερμοκρασία. Για παράδειγμα, μπορείτε να διαλύσετε περισσότερο αλάτι σε ζεστό νερό παρά σε κρύο νερό.
Ωστόσο, μπορεί να υπάρχουν εξαιρέσεις, για παράδειγμα, η διαλυτότητα των αερίων στο νερό μειώνεται με την αύξηση της θερμοκρασίας. Στην περίπτωση αυτή, τα μόρια διαλυτής ουσίας δέχονται κινητική ενέργεια όταν θερμαίνονται, γεγονός που διευκολύνει τη διαφυγή τους.
Πίεση
Η αύξηση της πίεσης μπορεί να αναγκάσει τη διάλυση της διαλυμένης ουσίας. Αυτό χρησιμοποιείται συνήθως για τη διάλυση των αερίων σε υγρά.
Χημική σύνθεση
Η φύση της διαλελυμένης ουσίας και του διαλύτη και η παρουσία άλλων χημικών ενώσεων στο διάλυμα επηρεάζουν τη διαλυτότητα. Για παράδειγμα, μπορείτε να διαλύσετε μεγαλύτερη ποσότητα ζάχαρης στο νερό, από το αλάτι στο νερό. Σε αυτή την περίπτωση λέγεται ότι η ζάχαρη είναι πιο διαλυτή.
Η αιθανόλη στο νερό είναι πλήρως διαλυτή μεταξύ τους. Στην συγκεκριμένη περίπτωση, ο διαλύτης θα είναι η ένωση που είναι σε μεγαλύτερη ποσότητα.
Μηχανικοί παράγοντες
Σε αντίθεση με την ταχύτητα διάλυσης, η οποία εξαρτάται κυρίως από τη θερμοκρασία, η ταχύτητα των ανακρυστάλλωση εξαρτάται από τη συγκέντρωση της διαλυμένης ουσίας στην επιφάνεια του κρυσταλλικού πλέγματος, αν ευνοείται όταν ένα διάλυμα είναι ακίνητος.
Επομένως, την ανάδευση της λύσης αποφύγετε αυτή τη συσσώρευση, μεγιστοποιώντας τη διάλυση (αιχμές κορεσμού, 2014).
Καμπύλες κορεσμού και διαλυτότητας
Οι καμπύλες διαλυτότητας είναι μια γραφική βάση δεδομένων όπου συγκρίνεται η ποσότητα της διαλελυμένης ουσίας που διαλύεται σε μια ποσότητα διαλύτη, σε μια ορισμένη θερμοκρασία.
Οι καμπύλες διαλυτότητας σχεδιάζονται συνήθως για μια ποσότητα διαλελυμένης ουσίας, στερεού ή αερίου, σε 100 γραμμάρια νερού (Brian, 2014).
Το σχήμα 2 απεικονίζει τις καμπύλες κορεσμού για διάφορες διαλυμένες ουσίες στο νερό.

Στον άξονα των συντεταγμένων, έχετε τη θερμοκρασία σε βαθμούς εκατοντάβατο και στον άξονα των τετμημένων έχετε τη συγκέντρωση της διαλελυμένης ουσίας που εκφράζεται σε γραμμάρια διαλυμένης ουσίας ανά 100 γραμμάρια νερού.
Η καμπύλη υποδεικνύει το σημείο κορεσμού σε μια ορισμένη θερμοκρασία. Η περιοχή κάτω από την καμπύλη υποδηλώνει ότι έχετε μια ακόρεστη λύση και ως εκ τούτου μπορείτε να προσθέσετε περισσότερη διαλυμένη ουσία.
Η περιοχή πάνω από την καμπύλη έχει ένα υπερκορεσμένο διάλυμα. (Καμπύλες διαλυτότητας, s.f.)
Λαμβάνοντας ως παράδειγμα το χλωριούχο νάτριο (NaCl), στους 25 βαθμούς Κελσίου, μπορείτε να διαλύσετε περίπου 35 γραμμάρια NaCl σε 100 γραμμάρια νερού για να αποκτήσετε ένα κορεσμένο διάλυμα. (Cambrige University, s.f.)
Παραδείγματα κεκορεσμένων διαλυμάτων
Κορεσμένα διαλύματα μπορούν να βρεθούν καθημερινά, δεν είναι απαραίτητο να βρίσκονται σε χημικό εργαστήριο. Ο διαλύτης δεν πρέπει απαραίτητα να είναι νερό. Παρακάτω παρατίθενται καθημερινά παραδείγματα κορεσμένων διαλυμάτων:
-Η σόδα και τα αναψυκτικά γενικά είναι διαλύματα κορεσμένα με διοξείδιο του άνθρακα στο νερό. Γι 'αυτό, όταν απελευθερώνεται η πίεση, σχηματίζονται φυσαλίδες διοξειδίου του άνθρακα.
-Τα εδάφη του εδάφους είναι κορεσμένα με άζωτο.
-Μπορείτε να προσθέσετε ζάχαρη ή αλάτι στο ξίδι για να σχηματίσουν ένα κορεσμένο διάλυμα.
-Προσθέστε σκόνη σοκολάτας στο γάλα έως ότου δεν διαλύεται, σχηματίζοντας ένα κορεσμένο διάλυμα.
-Το γάλα μπορεί να κορεστεί με αλεύρι σε τέτοιο βαθμό ώστε να μην μπορεί να προστεθεί πλέον αλεύρι στο γάλα.
-Το λιωμένο βούτυρο μπορεί να κορεστεί με αλάτι, όταν το αλάτι δεν διαλύεται πλέον.
Τι είναι μια υπερκορεσμένη λύση?
Ο ορισμός ενός υπερκορεσμένου διαλύματος είναι αυτός που περιέχει περισσότερο διαλελυμένη διαλυτή ουσία από ότι κανονικά θα διαλύεται στον διαλύτη. Αυτό γίνεται συνήθως με την αύξηση της θερμοκρασίας του διαλύματος.
Μια μικρή αλλαγή του διαλύματος ή η εισαγωγή ενός "σπόρου" ή μικροσκοπικού κρυστάλλου της διαλελυμένης ουσίας θα αναγκάσει την κρυστάλλωση της πλεονάζουσας διαλελυμένης ουσίας. Εάν δεν υπάρχει σημείο πυρήνωσης για σχηματισμό κρυστάλλων, η περίσσεια διαλυμένης ουσίας μπορεί να παραμείνει σε διάλυμα.
Μια άλλη μορφή υπερκορεσμού μπορεί να συμβεί όταν ένα κορεσμένο διάλυμα ψύχεται προσεκτικά. Αυτή η αλλαγή στις συνθήκες σημαίνει ότι η συγκέντρωση είναι στην πραγματικότητα μεγαλύτερη από το σημείο κορεσμού, η λύση έχει υπερκορεσθεί.
Αυτό μπορεί να χρησιμοποιηθεί στη διαδικασία ανακρυστάλλωσης για τον καθαρισμό ενός χημικού: διαλύεται στο σημείο κορεσμού σε θερμό διαλύτη, στη συνέχεια, ως τις ψύχει διαλύτη και μειώνεται η διαλυτότητα, η περίσσεια διαλυμένης ουσίας ιζήματα.
Οι ακαθαρσίες, οι οποίες υπάρχουν σε πολύ χαμηλότερη συγκέντρωση, δεν κορεώνουν τον διαλύτη και έτσι παραμένουν διαλυμένες στο υγρό.
Αναφορές
- Anne Marie Helmenstine, Π. (2016, 7 Ιουλίου). Ορισμός και παραδείγματα κορεσμένου διαλύματος. Ανακτήθηκε από περίπου: about.com
- Πανεπιστήμιο Cambrige. (s.f.). Καμπύλες διαλυτότητας. Ανακτήθηκε από το dynamicscience.com: dynamicscience.com.au.
- Παραδείγματα κορεσμένου διαλύματος. (s.f.). Ανακτήθηκε από τον δικτυακό σας τόπο: examples.yourdictionary.com.
- , S. (2014, 4 Ιουνίου). Κορεσμένες και υπερκορεσμένες λύσεις. Ανακτήθηκε από socratic.org: socratic.org.
- James, Ν. (S.f.). Κορεσμένη Λύση: Ορισμός & Παραδείγματα. Ανακτήθηκε από study.com: study.com.
- , Β. (2014, 14 Οκτωβρίου). Κορεσμένες και υπερκορεσμένες λύσεις. Ανακτήθηκε από socratic.org: socratic.org.
- Καμπύλες διαλυτότητας. (s.f.). Ανακτήθηκε από την KentChemistry: kentchemistry.com.
- Τύποι κορεσμού. (2014, 26 Ιουνίου). Ανακτήθηκε από τη χημεία libretex: chem.libretexts.org.


