Φόρμουλα Υδροξειδίου Ασβεστίου, Ιδιότητες, Δραστικότητα και Χρήσεις
Το υδροξείδιο ασβεστίου, επίσης γνωστή ως ένυδρος άσβεστος ή ασβέστος σκωρίας, είναι μια ανόργανη ένωση του τύπου Ca (OH)2.
Το υδροξείδιο του ασβεστίου υιοθετεί μια πολυμερή δομή, όπως όλα τα υδροξείδια μετάλλων, ίδια με αυτή του υδροξειδίου του μαγνησίου (Mg (OH))2) επίσης γνωστή ως brucita.
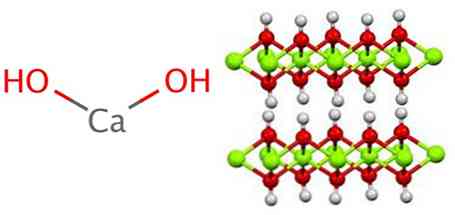
Μπορεί να φανεί ότι σε αυτή τη δομή υπάρχει ο σχηματισμός γέφυρων υδρογόνου. Το υδροξείδιο του ασβεστίου συντίθεται βιομηχανικά αντιδρώντας το οξείδιο του ασβεστίου, επίσης γνωστό ως ασβέστη ή ασβέστη, με νερό σύμφωνα με την ακόλουθη αντίδραση:
CaOH + Η2O → Ca (OH)2
Παρασκευάζεται επίσης στο εργαστήριο με την αντίδραση μεταξύ υδατικού χλωριούχου ασβεστίου και υδροξειδίου του νατρίου.
Το υδροξείδιο του ασβεστίου εμφανίζεται φυσικά, αλλά σπάνια σε μορφή ορυκτών όπως το πορτολάνιτο, το οποίο βρίσκεται σε μερικά ηφαιστειακά και μεταμορφωμένα πετρώματα. (Χημικός τύπος υδροξειδίου του ασβεστίου - Χρήσεις υδροξειδίου του ασβεστίου, ιδιότητες, δομή και φόρμουλα, 2005-2017).
Αυτή η ένωση είναι επίσης διαθέσιμη σε τσιμέντο, διαλύτες και βιομηχανικά καθαριστικά (όπως δομικά προϊόντα), απογυμνωτές δαπέδου, καθαριστικά τούβλων, προϊόντα πάχυνσης τσιμέντου και πολλά άλλα..
Το υδατικό διάλυμα ονομάζεται συνήθως ασβέστιο. Το ασβέστιο νερό παρασκευάζεται με ανάδευση υδροξειδίου του ασβεστίου σε καθαρό νερό και διήθηση της περίσσειας Ca (OH)2 δεν διαλύθηκε.
Όταν το υδροξείδιο του ασβεστίου προστίθεται σε περίσσεια νερό ασβέστη, ένα εναιώρημα σωματιδίων υδροξειδίου του ασβεστίου επιτυγχάνεται, δίνοντας μια γαλακτώδη εμφάνιση, στην οποία περίπτωση έχει την κοινή ονομασία του γάλακτος ασβέστου. Το γάλα ασβέστου ή ένα κορεσμένο διάλυμα ασβέστη (ασβέστη νερό) έχει ένα pH 12,3, είναι βασικής φύσης.
Φυσικές και χημικές ιδιότητες του υδροξειδίου του ασβεστίου
Το υδροξείδιο του ασβεστίου είναι μια λευκή ή άχρωμη σκόνη, απαλλαγμένη από οσμή. Σε υδατικό διάλυμα (κορεσμένα διαλύματα) έχει γαλακτώδη εμφάνιση λόγω του υπερκείμενου διαλύματος του αδιάλυτου υδροξειδίου του ασβεστίου.
Τα ακόρεστα διαλύματα είναι συνήθως διαυγή και άχρωμα διαλύματα, με ελαφρά γήινη οσμή και πικρή αλκαλική γεύση υδροξειδίου του ασβεστίου. Η εμφάνιση της ένωσης απεικονίζεται στο Σχήμα 3 (Royal Society of Chemistry, 2015).

Το υδροξείδιο του ασβεστίου έχει μοριακό βάρος 74,093 g / mol και πυκνότητα 2,211 g / cm3 στη στερεά κατάσταση. Έχει σημείο τήξης 580 βαθμούς Κελσίου. Είναι ελάχιστα διαλυτό στο νερό, ικανό να διαλύσει 1,89 γραμμάρια ανά λίτρο στους 0 ° C, 1,73 γραμμάρια ανά λίτρο στους 20 ° C και 0,66 γραμμάρια ανά λίτρο στους 100 ° C.
Είναι διαλυτό σε γλυκερόλη και σε όξινα διαλύματα. Είναι αδιάλυτο στο αλκοόλ (Εθνικό Κέντρο Βιοτεχνολογικών Πληροφοριών, S.F.).
Το υδροξείδιο του ασβεστίου διαλύεται μερικώς σε νερό για να παραχθεί ένα διάλυμα που ονομάζεται ασβέστιο, το οποίο είναι μέτρια βάση. Το ασβέστιο ή το Ca (OH)2 (υδ) Αντιδρά με οξέα για να σχηματίσει άλατα και μπορεί να προσβάλει μερικά μέταλλα όπως αλουμίνιο. Το ασβέστιο αντιδρά εύκολα με διοξείδιο του άνθρακα για να σχηματίσει ανθρακικό ασβέστιο, μια χρήσιμη διαδικασία που ονομάζεται ανθρακική:
Ca (ΟΗ)2 + CO2 → CaCO3 + H2Ο
Οι νιτροπραφίνες, νιτρομεθάνιο, νιτροπροπάνιο, κλπ. Σχηματίζουν άλατα με ανόργανες βάσεις όπως υδροξείδιο του ασβεστίου. Αυτά τα ξηρά άλατα είναι εκρηκτικά. Η ένωση είναι χημικά όμοια με υδροξείδιο του νατρίου (NaOH) ή οξείδιο του νατρίου (Na2Ο). Αυτά εξουδετερώνουν τα οξέα εξωθερμικά για να σχηματίσουν άλατα συν νερό.
Η ανάμειξη αυτών των υλικών με νερό μπορεί να δημιουργήσει ανασφαλείς ποσότητες θερμότητας, καθώς η βάση διαλύεται ή αραιώνεται. Οι βάσεις αντιδρούν με ορισμένα μέταλλα (όπως αλουμίνιο και ψευδάργυρο) για να σχηματίσουν οξείδια ή υδροξείδια μετάλλων και παράγουν αέριο υδρογόνο.
Οι βάσεις μπορούν να προκαλέσουν αντιδράσεις πολυμερισμού σε πολυμεριζόμενες οργανικές ενώσεις, ειδικά εποξείδια. Μπορούν να δημιουργηθούν εύφλεκτα και / ή τοξικά αέρια με άλατα αμμωνίου, νιτρίδια, αλογονωμένα οργανικά, διάφορα μέταλλα, υπεροξείδια και υδροϋπεροξείδια. Αυτός ο τύπος ένωσης συχνά χρησιμεύει ως καταλύτης (Χημικό δελτίο CALCIUM HYDROXIDE, S.F.).
Δραστικότητα και κίνδυνοι

Το υδροξείδιο του ασβεστίου είναι μια σταθερή ένωση αν και ασυμβίβαστη με ισχυρά οξέα. Είναι ταξινομημένο ως ερεθιστική ένωση και μεταξύ των κινδύνων που μπορούμε να τονίσουμε:
Είναι διαβρωτικό για τα μάτια (προκαλούν βλάβη του κερατοειδούς ή τύφλωση) και το δέρμα (προκαλούν φλεγμονή και φουσκάλες).
Η εισπνοή σκόνης θα προκαλέσει ερεθισμό στο γαστρεντερικό ή αναπνευστικό σύστημα, που χαρακτηρίζεται από καύση, φτέρνισμα και βήχα. Η σοβαρή υπερέκθεση μπορεί να προκαλέσει βλάβη στους πνεύμονες, ασφυξία, απώλεια αισθήσεων ή θάνατο. Η φλεγμονή του οφθαλμού χαρακτηρίζεται από ερυθρότητα, ερεθισμό και φαγούρα (Φύλλο δεδομένων ασφαλείας υλικών υδροξείδιο του ασβεστίου, 2013).
Η επανειλημμένη έκθεση στα μάτια σε χαμηλό επίπεδο σκόνης μπορεί να προκαλέσει ερεθισμό και τοπική καταστροφή του δέρματος ή δερματίτιδα στο δέρμα. Επαναλαμβανόμενη εισπνοή σκόνης μπορεί να προκαλέσει μεταβλητό βαθμό ερεθισμού του αναπνευστικού συστήματος ή βλάβη πνευμόνων.
Αν αυτή η χημική ουσία έρθει σε επαφή με τα μάτια, θα πρέπει να πλυθούν αμέσως με μεγάλες ποσότητες νερού, μερικές φορές να σηκώνουν το κάτω και το ανώτερο βλέφαρο. Απαιτείται άμεση ιατρική φροντίδα. Οι φακοί επαφής δεν πρέπει να χρησιμοποιούνται όταν εργάζεστε με αυτό το χημικό προϊόν.
Εάν η χημική ουσία έρθει σε επαφή με το δέρμα, το δέρμα που έχει μολυνθεί με σαπούνι και νερό πρέπει να ξεπλυθεί αμέσως. Αν αυτή η χημική ουσία διαπερνά τα ρούχα, αφαιρέστε αμέσως τα ρούχα και ξεπλύνετε το δέρμα με νερό. Εάν ο ερεθισμός επιμείνει μετά το πλύσιμο, ζητήστε ιατρική βοήθεια.
Σε περίπτωση εισπνοής μεγάλων ποσοτήτων αυτού του χημικού, το εκτεθειμένο άτομο πρέπει να μεταφερθεί αμέσως στον καθαρό αέρα. Εάν η αναπνοή έχει σταματήσει, κάντε αναζωογόνηση από το στόμα σε στόμα, διατηρώντας επίσης το θύμα ζεστό και σε ηρεμία. Ζητήστε ιατρική βοήθεια το συντομότερο δυνατόν.
Σε περίπτωση κατάποσης, αναζητήστε αμέσως ιατρική συμβουλή και, ει δυνατόν, δείξτε το δοχείο ή την ετικέτα (δηλητηρίαση με υδροξείδιο του ασβεστίου, 2017).
Χειρισμός και αποθήκευση
- Η ένωση πρέπει να διατηρείται σε ξηρό δοχείο.
- Μην καταπιείτε ή αναπνέετε τη σκόνη.
- Δεν πρέπει ποτέ να προστίθεται νερό σε αυτό το προϊόν.
- Σε περίπτωση έλλειψης αερισμού, φέρτε επαρκή αναπνευστική συσκευή.
- Αποφύγετε την επαφή με το δέρμα και τα μάτια.
- Διατηρείτε μακριά από ασυμβίβαστα ως οξέα.
- Κρατήστε το δοχείο ερμητικά κλειστό.
- Φυλάσσετε το δοχείο σε δροσερό και καλά αεριζόμενο χώρο. Μη φυλάσσετε πάνω από 25 βαθμούς Κελσίου.
Χρήσεις και εφαρμογές

Το υδροξείδιο του ασβεστίου παράγεται σε μεγάλη κλίμακα, είναι εύκολο να χειριστεί και είναι γενικά φθηνό, συνεπώς, υπάρχουν πολλές αξιοσημείωτες χρήσεις και εφαρμογές.
Μια σημαντική εφαρμογή υδροξειδίου του ασβεστίου είναι σαν ένα κροκιδωτικό σε νερό και επεξεργασία λυμάτων. Δημιουργεί ένα χνουδωτό φορτισμένο στερεό που βοηθά στην απομάκρυνση μικρότερων σωματιδίων από το νερό, με αποτέλεσμα ένα ελαφρύτερο προϊόν.
Η εφαρμογή αυτή ενεργοποιείται από το χαμηλό κόστος και τη χαμηλή τοξικότητα του υδροξειδίου του ασβεστίου. Χρησιμοποιείται επίσης στην επεξεργασία γλυκού νερού για την αύξηση του pH του νερού. Ο σκοπός είναι ότι οι σωλήνες δεν διαβρώνονται όπου το νερό βάσης είναι όξινο.
Μια άλλη μεγάλη εφαρμογή είναι στη χαρτοβιομηχανία, όπου χρησιμοποιείται στην παραγωγή υδροξειδίου του νατρίου. Αυτή η μετατροπή είναι ένα συστατικό της γνωστής διαδικασίας kraft που χρησιμοποιείται στην εκχύλιση πολτού.
Σε συστήματα υποστήριξης της ζωής ως καθαριστής διοξείδιο του άνθρακα, ιδιαίτερα σε εκ νέου αναπνοής καταδύσεις κλειστό κύκλωμα, όπου το υδροξείδιο του λιθίου να είναι πιο καυστικό, θεωρείται πολύ επικίνδυνη.
Χρησιμοποιείται ως συστατικό λεύκανσης και σοβάτισμα, με τα λεγόμενα ασβεστοκονιάματα. Στην οδοποιία, το υδροξείδιο του ασβεστίου χρησιμεύει για τη βελτίωση της ποιότητας του εδάφους.
Σύμφωνα με τα Εθνικά Ινστιτούτα Υγείας, υδροξείδιο του ασβεστίου χρησιμοποιείται συνήθως σε οδοντιατρικές εργασίες ως αντιμικροβιακό, και είναι η ουσία της επιλογής για να σχηματιστεί ένα προστατευτικό στρώμα φραγμού γνωστή ως κορυφαία.
Τα οπτικά εμπόδια χρησιμοποιούνται συνήθως ως μέσο για την αποφυγή της νέκρωσης των πνευμόνων σε καταστάσεις όπου η ενδοδοντική χειρουργική επέμβαση θα ήταν ιδιαίτερα δύσκολη, η οποία είναι συνήθως αποτέλεσμα ενός ανώριμου μόνιμου δοντιού.
Δεδομένου ότι το υδροξείδιο του ασβεστίου μπορεί να βοηθήσει την απολύμανση ενός δοντιού, όπου μια υπάρχουσα μόλυνση μπορεί να χρησιμοποιηθεί ως μια βραχυπρόθεσμη θεραπεία για τη μείωση πόνου και της φλεγμονής σε προετοιμασία για ενδοδοντική χειρουργική επέμβαση (Gottfried Schmalz, 2009).
Χρησιμεύει ως πρόσθετο για το θαλασσινό νερό, επειδή μειώνει το ατμοσφαιρικό CO2 και μετριάζει το φαινόμενο του θερμοκηπίου.
Στην παραγωγή μετάλλων, ο ασβέστος εισάγεται με έγχυση στο ρεύμα των αποβλήτων για την εξουδετέρωση των οξέων, όπως τα φθοριούχα και χλωριούχα, προτού απελευθερωθούν στην ατμόσφαιρα.
Το υδροξείδιο του ασβεστίου χρησιμοποιείται ως ενεργό αλκαλικό συστατικό σε ορισμένα προϊόντα χαλάρωσης μαλλιών.
Σύμφωνα με το Cornell Κέντρο Υλικών Ερευνών, υδροξείδιο του ασβεστίου μπορεί να ισιώσει σγουρά μαλλιά γιατί σπάει τους δισουλφιδικούς δεσμούς που συνδέουν κυστεΐνης, αμινοξέα τα οποία είναι παρόντα σε υψηλότερες συγκεντρώσεις σε φυσικά σγουρά μαλλιά. Το σπάσιμο αυτών των δεσμών και η στεγανοποίησή τους με υδροξείδιο του ασβεστίου μεταβάλλει μόνιμα τη φυσική δομή των επεξεργασμένων μαλλιών.
Στο μείγμα Bordeaux, το υδροξείδιο του ασβεστίου χρησιμεύει για να εξουδετερώσει το διάλυμα και να σχηματίσει ένα μυκητοκτόνο μακράς διάρκειας.
Χρησιμοποιείται στο λάδι βιομηχανία διύλισης για την παρασκευή προσθέτων για έλαια (salicáticos, sulfáticos, Φαινόλες), στην πετροχημική βιομηχανία για την παραγωγή στερεών έλαιο των διαφόρων σημάτων και επίσης στη χημική βιομηχανία για την παρασκευή του στεατικού ασβεστίου . Χρησιμοποιείται συνήθως για την εξέταση της απορρόφησης διοξειδίου του άνθρακα και αερίου.
Το υδροξείδιο του ασβεστίου χρησιμοποιείται στην κατασκευή ταμπόν φρένων, στην παρασκευή ξηρών μιγμάτων για βαφή και διακόσμηση και επίσης στην παρασκευή μιγμάτων για φυτοφάρμακα.
Χρησιμοποιείται επίσης ως συμπλήρωμα ασβεστίου και ρυθμιστικό διάλυμα ρΗ / ανθρακικού άλατος για την υδατοκαλλιέργεια κοραλλιών στα ενυδρεία των υφάλων.
Είναι μια «εναλλακτική» φυσικό εντομοκτόνο, πιο έρποντα έντομα πεθαίνουν από την επαφή με αυτό, συμπεριλαμβανομένων τσιμπουριών, ψύλλων, σκαθάρια και οι προνύμφες (Russiver, 2015).
Το υδροξείδιο του ασβεστίου είναι μια αποτελεσματική λύση για το διαχωρισμό των μαλλιών από τα δέρματα των ζώων, κατά την παρασκευή τους για την παραγωγή δέρματος.
Ένα μείγμα υδροξειδίου του ασβεστίου και ζεστού νερού δημιουργεί ένα λουτρό στο οποίο τα νωπά δέρματα θα πρέπει να εμποτιστούν μέχρι τέσσερις ημέρες και να αναταράσσονται συχνά. Αυτή η διαδικασία χαλάει τα μαλλιά και το δέρμα, σε τέτοιο βαθμό που συνήθως μπορεί να αφαιρεθεί με το χέρι.
Λόγω της χαμηλής του τοξικότητας και της απαλότητας των βασικών ιδιοτήτων του, ο ασβεστοποιημένος ασβέστης χρησιμοποιείται ευρέως στη βιομηχανία τροφίμων για να:
- Αποσαφήνιση των πρώτων χυμό από ζαχαροκάλαμο ή ζαχαρότευτλα στη βιομηχανία ζάχαρης, νερού για οινοπνευματώδη ποτά και αναψυκτικά, τουρσιά και άλλα τρόφιμα.
- Κάνετε τορτίγια καλαμποκιού (βοηθήστε το καλαμπόκι να έρθει μαζί). Καλαμπόκι μαγειρεμένα με ασβέστη γίνεται Hominy, η οποία αυξάνει σημαντικά τη βιοδιαθεσιμότητα της νιασίνης, θεωρούνται επίσης νοστιμότερα και πιο εύπεπτες.
- Καθαρίστε μια άλμη ανθρακικού ασβεστίου και μαγνησίου στην παρασκευή αλατιού για φαγητό και φαρμακευτική χρήση.
- Ενίσχυση ποτών φρούτων, όπως χυμός πορτοκαλιού, και βρεφικής φόρμουλας (BAUM, 2013).
Αναφορές
- BAUM, J. (2013, 16 Αυγούστου). Χρήση υδροξειδίου του ασβεστίου. Ανακτήθηκε από livestrong.com: livestrong.com.
- Υδροξείδιο του ασβεστίου Τύπος - υδροξείδιο του ασβεστίου Χρήσεις, ιδιότητες, δομή και τύπος. (2005-2017). Ανακτήθηκε από το softschools.com.
- Δηλητηρίαση με υδροξείδιο του ασβεστίου. (2017, 7 Φεβρουαρίου). Ανακτήθηκε από medlineplus.gov.
- Φύλλο χημικών ουσιών ΥΔΡΟΞΕΙΔΙΟ ΑΣΒΕΣΤΙΟΥ. (S.F.). Ανακτήθηκε από cameochemicals.noaa.gov.
- Gottfried Schmalz, D. Α. (2009). Βιοσυμβατότητα των οδοντικών υλικών. Βερολίνο: άνοιξη.
- Φύλλο δεδομένων ασφαλείας υλικών Υδροξείδιο του ασβεστίου. (2013, 21 Μαΐου). Ανακτήθηκε από sciencelab: sciencelab.com.
- Εθνικό Κέντρο Βιοτεχνολογικών Πληροφοριών. (S.F.). Δημοσιευμένη βάση δεδομένων PubChem. CID = 6093208. Ανακτήθηκε από το pubchem.ncbi.nlm.nih.gov.
- Βασιλική Εταιρεία Χημείας. (2015). Υδροξείδιο ασβεστίου. Ανακτήθηκε από το ChemSpider: chemspider.com.
- Russiver, Μ. (2015, 17 Αυγούστου). Τι είναι το υδροξείδιο του ασβεστίου; Ανακτήθηκε από quora: quora.com.


