Διάρθρωση υδροξειδίου του αμμωνίου, ιδιότητες, ονοματολογία, χρήσεις
Το υδροξειδίου του αμμωνίου είναι μια ένωση του μοριακού τύπου NH4ΟΗ ή Η5Δεν παράγεται από τη διάλυση του αερίου αμμωνίας (NH3) σε νερό. Για το λόγο αυτό, λαμβάνει τα ονόματα αμμωνιακού νερού ή υγρής αμμωνίας.
Πρόκειται για ένα άχρωμο υγρό με πολύ έντονη και έντονη οσμή, που δεν είναι μονωτική. Αυτά τα χαρακτηριστικά έχουν άμεση σχέση με τη συγκέντρωση του ΝΗ3 διαλυμένο στο νερό. συγκέντρωση που στην πραγματικότητα, ως αέριο, μπορεί να καλύψει τεράστιες ποσότητες διαλύεται σε μικρό όγκο νερού.
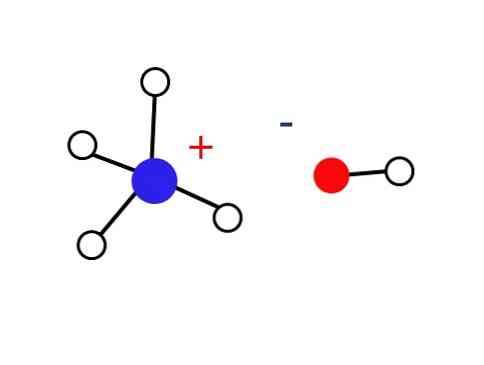
Ένα σημαντικά μικρό μέρος αυτών των υδατικών διαλυμάτων αποτελείται από κατιόντα ΝΗ4+ και ανιόντα ΟΗ-. Από την άλλη πλευρά, σε πολύ αραιά διαλύματα ή σε κατεψυγμένα στερεά σε πολύ χαμηλές θερμοκρασίες η αμμωνία μπορεί να βρεθεί με τη μορφή ενυδατωμένων, όπως: NH3∙ H2Ο, 2ΝΗ3∙ H2Ο και ΝΗ3∙ 2H2Ο.
Ως περίεργο γεγονός, τα σύννεφα του Δία σχηματίζονται από αραιωμένα διαλύματα υδροξειδίου του αμμωνίου. Ωστόσο, ο διαστημικός καθετήρας Galileo απέτυχε να βρει νερό στα σύννεφα του πλανήτη, κάτι που αναμένεται από τη γνώση ότι ο σχηματισμός υδροξειδίου του αμμωνίου είναι γνωστός. δηλαδή, είναι κρύσταλλοι NH4ΟΗ είναι εντελώς άνυδρο.
Το ιόν αμμωνίου (ΝΗ4+) παράγεται στον νεφρικό σωληνοειδή αυλό με την ένωση αμμωνίας και υδρογόνου, που εκκρίνεται από τα νεφρικά σωληνοειδή κύτταρα. Παρομοίως, το αμμώνιο παράγεται σε νεφρικά σωληνοειδή κύτταρα κατά τη διαδικασία μετασχηματισμού της γλουταμίνης σε γλουταμικό άλας και με τη σειρά της, στην μετατροπή του γλουταμικού σε α-κετογλουταρική.
Η αμμωνία παράγεται βιομηχανικά με τη μέθοδο Haber-Bosch, στην οποία αντιδρούν τα αέρια αζώτου και υδρογόνου. χρησιμοποιώντας το ιόν σιδήρου, οξείδιο αργιλίου και οξείδιο του καλίου ως καταλύτες. Η αντίδραση πραγματοποιείται σε υψηλές πιέσεις (150-300 atm) και υψηλές θερμοκρασίες (400 -500 ° C), απόδοση 10 -20%.
Στην αντίδραση παράγεται αμμωνία, η οποία, όταν οξειδώνεται, παράγει νιτρώδη και νιτρικά. Αυτά είναι απαραίτητα για τη λήψη νιτρικού οξέος και λιπασμάτων όπως το νιτρικό αμμώνιο.
Ευρετήριο
- 1 Χημική δομή
- 1.1 Αμμωνιακός πάγος
- 2 Φυσικές και χημικές ιδιότητες
- 2.1 Μοριακός τύπος
- 2.2 Μοριακό βάρος
- 2.3 Εμφάνιση
- 2.4 Συγκέντρωση
- 2.5 Οσμή
- 2.6 Γεύση
- 2.7 Οριακή τιμή
- 2.8 Σημείο ζέσεως
- 2.9 Διαλυτότητα
- 2.10 Διαλυτότητα στο νερό
- 2.11 Πυκνότητα
- 2.12 Πυκνότητα ατμών
- 2.13 Πίεση ατμού
- 2.14 Διαβρωτική δράση
- 2.15 ρΗ
- 2.16 Σταθερότητα διάστασης
- 3 Ονοματολογία
- 4 Διαλυτότητα
- 5 Κίνδυνοι
- 5.1 Δραστικότητα
- 6 Χρήσεις
- 6.1 Σε τρόφιμα
- 6.2 Θεραπευτική
- 6.3 Βιομηχανικά και διάφορα
- 6.4 Στη γεωργία
- 7 Αναφορές
Χημική δομή
Όπως υποδεικνύεται από τον ορισμό του, το υδροξείδιο του αμμωνίου αποτελείται από ένα υδατικό διάλυμα αερίου αμμωνίας. Επομένως, μέσα στο υγρό, δεν υπάρχει άλλη καθορισμένη δομή εκτός από την τυχαία διάταξη των ιόντων ΝΗ4+ και OH- επιδιαλυτωμένα από μόρια νερού.
ιόντα αμμωνίου και υδροξυλίου είναι προϊόντα μιας υδρόλυσης ισορροπίας της αμμωνίας, έτσι είναι κοινό για αυτά τα διαλύματα παρουσιάζουν μια πικάντικη οσμή:
NH3(g) + Η2O (l) <=> NH4+(ac) + ΟΗ-(ac)
Σύμφωνα με τη χημική εξίσωση, μια μεγάλη μείωση της συγκέντρωσης νερού θα μετατοπίζει την ισορροπία στο σχηματισμό περισσότερης αμμωνίας. δηλαδή, καθώς το υδροξείδιο του αμμωνίου θερμαίνεται, οι ατμοί αμμωνίας θα απελευθερωθούν.
Για το λόγο αυτό, τα ιόντα ΝΗ4+ και OH- δεν καταφέρνουν να σχηματίσουν κρύσταλλο στις επίγειες συνθήκες, αυτό που φέρνει ως συνέπεια ότι η στερεή βάση NH4Το OH δεν υπάρχει.
Αυτό το στερεό πρέπει να αποτελείται μόνο από ιόντα που αλληλεπιδρούν ηλεκτροστατικά (όπως φαίνεται στην εικόνα).
Αμμωνιακός πάγος
Ωστόσο, κάτω από θερμοκρασίες αρκετά κάτω από 0 ° C, και που περιβάλλεται από τεράστιες πιέσεις, όπως αυτές που επικρατούν στους πυρήνες των παγωμένων φεγγιών, την αμμωνία και το πάγωμα του νερού. Με τον τρόπο αυτό, κρυσταλλώνονται σε ένα στερεό μίγμα με ποικίλες στοιχειομετρικές αναλογίες, που είναι το απλούστερο NH3∙ H2Ο: μονοένυδρη αμμωνία.
Το ΝΗ3∙ H2Ο και το ΝΗ3∙ 2H2Ή είναι αμμωνιακός πάγος, επειδή το στερεό αποτελείται από μια κρυσταλλική διάταξη μορίων νερού και αμμωνίας ενωμένες με δεσμούς υδρογόνου.
Δεδομένου ότι μια αλλαγή σε Τ και Ρ, σύμφωνα με υπολογιστικές μελέτες προσομοίωση όλων φυσικές μεταβλητές και τις επιδράσεις τους σε αυτά τα παγωτά, μία μετάβαση από τη μία φάση απαντάται ΝΗ3∙ nH2Ή σε μια φάση NH4OH.
Επομένως, μόνο σε αυτές τις ακραίες συνθήκες, το NH4Το ΟΗ μπορεί να υπάρχει ως προϊόν πρωτονίωσης εντός του πάγου μεταξύ του ΝΗ3 και το Η2Ο:
NH3(ων) + Η2O (s) <=> NH4ΟΗ (ες)
Σημειώστε ότι αυτή τη φορά, σε αντίθεση με την υδρόλυση της αμμωνίας, τα είδη που εμπλέκονται είναι σε μια στερεή φάση. Ένας αμμωνιακός πάγος που γίνεται αλμυρός χωρίς απελευθέρωση αμμωνίας.
Φυσικές και χημικές ιδιότητες
Μοριακός τύπος
NH4ΟΗ ή Η5Όχι
Μοριακό βάρος
35,046 g / mol
Εμφάνιση
Πρόκειται για ένα άχρωμο υγρό.
Συγκέντρωση
Μέχρι περίπου 30% (για ιόντα ΝΗ4+ και OH-).
Οσμή
Πολύ ισχυρή και απότομη.
Γεύση
Acre.
Τιμή κατωφλίου
34 ppm για μη ειδική ανίχνευση.
Σημείο ζέσεως
38 ºC (25%).
Διαλυτότητα
Υπάρχει μόνο σε υδατικό διάλυμα.
Διαλυτότητα στο νερό
Αναμειγνύεται σε απεριόριστες αναλογίες.
Πυκνότητα
0,90 g / cm3 στους 25 ° C.
Πυκνότητα ατμών
Σχετικά με τον αέρα που λαμβάνεται ως μονάδα: 0.6. Δηλαδή, είναι λιγότερο πυκνό από τον αέρα. Ωστόσο, λογικά η αναφερόμενη τιμή αναφέρεται στην αμμωνία ως αέριο, όχι στα υδατικά διαλύματά της ή στο ΝΗ4OH.
Πίεση ατμού
2.160 mmHg στους 25 ° C.
Διαβρωτική δράση
Είναι ικανό να διαλύει ψευδάργυρο και χαλκό.
ρΗ
11.6 (διάλυμα 1 Ν). 11.1 (διάλυμα 0.1 Ν) και 10,6 (διάλυμα 0,01 Ν).
Διασπορά σταθερά
pKb = 4,767; Kb = 1,71 χ 10-5 στους 20 ° C
pKb = 4.751; Kb = 1,774 x 10-5 στους 25 ° C.
Η αύξηση της θερμοκρασίας αυξάνει σχεδόν ανεπαίσθητα την βασικότητα του υδροξειδίου του αμμωνίου.
Ονοματολογία
Ποια είναι όλα τα κοινά και επίσημα ονόματα που λαμβάνει η NH;4OH; Σύμφωνα με τα όσα ορίζει η IUPAC, το όνομά της είναι υδροξείδιο του αμμωνίου επειδή περιέχει το υδροξύλιο ανιόν.
Το αμμώνιο με το φορτίο του +1 είναι μονοσθενές, λόγος για τον οποίο χρησιμοποιείται η ονοματολογία Το απόθεμα ονομάζεται: υδροξείδιο του αμμωνίου (I).
Αν και το υδροξείδιο του αμμωνίου όρος είναι τεχνικά εσφαλμένη, δεδομένου ότι η ένωση δεν είναι απομονώσιμο (τουλάχιστον όχι στη Γη, όπως εξηγείται λεπτομερώς στην πρώτη παράγραφο).
Επιπλέον, το υδροξείδιο του αμμωνίου λαμβάνει τα ονόματα νερού αμμωνίας και υγρής αμμωνίας.
Διαλυτότητα
Το ΝΗ4ΟΗ, δεδομένου ότι δεν υπάρχουν άλατα σε χερσαίες συνθήκες, δεν μπορεί να εκτιμηθεί πόσο διαλυτή είναι σε διαφορετικούς διαλύτες.
Ωστόσο, θα περίμενε κανείς ότι θα ήταν εξαιρετικά διαλυτό στο νερό, αφού η διάλυσή του θα απελευθέρωνε τεράστιες ποσότητες NH3. Θεωρητικά, θα ήταν ένας καταπληκτικός τρόπος αποθήκευσης και μεταφοράς αμμωνίας.
Σε άλλους διαλύτες που είναι ικανοί να δέχονται δεσμούς υδρογόνου, όπως αλκοόλες και αμίνες, θα μπορούσε να αναμένεται ότι θα ήταν επίσης πολύ διαλυτό σε αυτά. Εδώ το κατιόν NH4+ είναι ένας δότης γεφυρών υδρογόνου και το ΟΗ- Λειτουργεί όπως και τα δύο.
Παραδείγματα τέτοιων αλληλεπιδράσεων με μεθανόλη θα είναι: Η3Ν+-Η-ΟΗΟΗ3 και HO- - HOCH3 (ΟΗΟΗ3 υποδεικνύει ότι το οξυγόνο δέχεται τον δεσμό υδρογόνου, όχι ότι η μεθυλική ομάδα συνδέεται με το Η).
Κίνδυνοι
-Σε επαφή με τα μάτια προκαλεί ερεθισμό που μπορεί να προκαλέσει βλάβη στα μάτια.
-Είναι διαβρωτικό. Ως εκ τούτου, σε επαφή με το δέρμα μπορεί να προκαλέσει ερεθισμό και σε υψηλές συγκεντρώσεις του αντιδραστηρίου, προκαλεί εγκαύματα στο δέρμα. Η επαναλαμβανόμενη επαφή του υδροξειδίου του αμμωνίου με το δέρμα μπορεί να προκαλέσει ξηρότητα, κνησμό και ερυθρότητα (δερματίτιδα).
-Η εισπνοή ψεκασμού υδροξειδίου του αμμωνίου μπορεί να προκαλέσει οξεία ερεθισμό της αναπνευστικής οδού, η οποία χαρακτηρίζεται από ασφυξία, βήχα ή δύσπνοια. Η παρατεταμένη ή επαναλαμβανόμενη έκθεση της ουσίας μπορεί να οδηγήσει σε υποτροπιάζουσες βρογχικές λοιμώξεις. Επίσης, η εισπνοή υδροξειδίου του αμμωνίου μπορεί να προκαλέσει ερεθισμό των πνευμόνων.
-Η έκθεση σε υψηλές συγκεντρώσεις υδροξειδίου του αμμωνίου μπορεί να αποτελεί επείγουσα ιατρική κατάσταση, καθώς μπορεί να συμβεί συσσώρευση υγρών στους πνεύμονες (πνευμονικό οίδημα).
-Η συγκέντρωση των 25 ppm έχει ληφθεί ως όριο έκθεσης σε 8ωρη εργασία, σε περιβάλλον όπου ο εργαζόμενος εκτίθεται στην επιβλαβή δράση του υδροξειδίου του αμμωνίου.
Δραστικότητα
-Επιπλέον, για τις πιθανές βλάβες στην υγεία από την έκθεση στο υδροξείδιο του αμμωνίου, υπάρχουν και άλλες προφυλάξεις που πρέπει να λαμβάνονται υπόψη κατά την εργασία με την ουσία.
-Το υδροξείδιο του αμμωνίου μπορεί να αντιδράσει με πολλά μέταλλα, όπως: αργύρου, χαλκού, μολύβδου και ψευδαργύρου. Αντιδρά επίσης με τα άλατα αυτών των μετάλλων για να σχηματίσει εκρηκτικές ενώσεις και απελευθερώνει αέριο υδρογόνο. η οποία, με τη σειρά της, είναι εύφλεκτη και εκρηκτική.
-Μπορεί να αντιδρά βίαια με ισχυρά οξέα, για παράδειγμα: υδροχλωρικό οξύ, θειικό οξύ και νιτρικό οξύ. Ομοίως, αντιδρά με τον ίδιο τρόπο με θειικό διμεθύλιο και αλογόνα.
-Αντιδρά με ισχυρές βάσεις, όπως υδροξείδιο του νατρίου και υδροξείδιο του καλίου, που παράγουν αέρια αμμωνία. Αυτό μπορεί να ελεγχθεί εάν παρατηρηθεί ισορροπία στο διάλυμα, στην οποία προστίθεται ιόντα ΟΗ- μετατοπίζει την ισορροπία στο σχηματισμό NH3.
-Τα μέταλλα χαλκού και αλουμινίου, καθώς και άλλα γαλβανισμένα μέταλλα, δεν πρέπει να χρησιμοποιούνται κατά το χειρισμό υδροξειδίου του αμμωνίου, λόγω της διαβρωτικής δράσης τους..
Χρησιμοποιεί
Στο φαγητό
-Χρησιμοποιείται ως πρόσθετο σε πολλά τρόφιμα στα οποία δρα ως διογκωτικός παράγοντας, έλεγχος του pH και παράγοντας φινιρίσματος της επιφάνειας των τροφίμων..
-Ο κατάλογος των τροφίμων στα οποία το υδροξείδιο του αμμωνίου χρησιμοποιείται είναι εκτεταμένη και περιλαμβάνει αρτοσκευάσματα, τυριά, σοκολάτες, καραμέλες και πουτίγκες.
-Το υδροξείδιο του αμμωνίου χαρακτηρίζεται ως ασφαλής ουσία από τον FDA για την επεξεργασία τροφίμων, υπό την προϋπόθεση ότι τηρούνται τα καθιερωμένα πρότυπα.
-Στα προϊόντα κρέατος χρησιμοποιείται ως αντιμικροβιακός παράγοντας, ικανός να εξαλείψει βακτηρίδια όπως το Ε. Coli, μειώνοντάς τα σε μη ανιχνεύσιμα επίπεδα. Τα βακτήρια βρίσκονται στο έντερο των βοοειδών, προσαρμόζοντάς το στο όξινο περιβάλλον. Το υδροξείδιο του αμμωνίου, ρυθμίζοντας το pH, εμποδίζει την ανάπτυξη βακτηριδίων.
Θεραπευτική
-Το υδροξείδιο του αμμωνίου έχει διάφορες θεραπευτικές χρήσεις, όπως:
-Το διάλυμα 10% χρησιμοποιείται ως αναπνευστικό διεγερτικό αντανακλαστικό
-Εξωτερικά χρησιμοποιείται στο δέρμα για τη θεραπεία τσιμπήματα και τσιμπήματα εντόμων - Λειτουργεί στο πεπτικό σύστημα ως αντιόξινο και καρμίνι, δηλαδή βοηθά στην εξάλειψη των αερίων.
Επιπλέον, χρησιμοποιείται ως τοπικό rubefacient για οξύ και χρόνιο μυοσκελετικό πόνο. Ως επακόλουθο της δραστικής δράσης του υδροξειδίου του αμμωνίου, υπάρχει τοπική αύξηση της ροής του αίματος, ερυθρότητα και ερεθισμός.
Βιομηχανικά και διάφορα
-Λειτουργεί στη μείωση των ΝΟχ (πολύ δραστικά αέρια, όπως οξείδιο του αζώτου (NO) και διοξείδιο του αζώτου (NO2)) για τις εκπομπές στοίβας και τη μείωση των εκπομπών NOx στις εκπομπές καμινάδας.
-Χρησιμοποιείται ως πλαστικοποιητικός παράγοντας. Πρόσθετα χρωμάτων και για την επεξεργασία επιφανειών.
-Αυξάνει το πορώδες της τρίχας επιτρέποντας στις χρωστικές της κηλίδας να έχουν μεγαλύτερη διείσδυση, η οποία επιτυγχάνει καλύτερο φινίρισμα.
-Το υδροξείδιο αμμωνίου χρησιμοποιείται ως αντιμικροβιακός παράγοντας για την επεξεργασία λυμάτων. Επιπλέον, παρεμβαίνει στη σύνθεση της χλωραμίνης. Αυτή η ουσία εκπληρώνει μια λειτουργία παρόμοια με το χλώριο στον καθαρισμό του νερού της πισίνας, έχοντας το πλεονέκτημα ότι είναι λιγότερο τοξικό.
-Χρησιμοποιείται ως αναστολέας διάβρωσης στη διαδικασία εξευγενισμού του πετρελαίου.
-Χρησιμοποιείται ως μέσο καθαρισμού σε διάφορα βιομηχανικά και εμπορικά προϊόντα, που χρησιμοποιούνται σε διάφορες επιφάνειες, όπως: ανοξείδωτος χάλυβας, πορσελάνη, γυαλί και φούρνος.
-Επιπλέον, χρησιμοποιείται στην παραγωγή απορρυπαντικών, σαπουνιών, φαρμάκων και μελανιών.
Στη γεωργία
Αν και δεν χορηγείται απευθείας ως λίπασμα, το υδροξείδιο αμμωνίου εκπληρώνει αυτή τη λειτουργία. Η αμμωνία παράγεται από το ατμοσφαιρικό άζωτο με τη μέθοδο Haber-Bosch και μεταφέρεται υπό ψύξη κάτω από το σημείο βρασμού (-33 ° C) στους τόπους χρήσης της.
Η αμμωνία υπό πίεση εγχέεται, υπό μορφή ατμού, στο έδαφος όπου αντιδρά αμέσως με το εδαφικό ύδωρ και διέρχεται στη μορφή αμμωνίου (NH4+), η οποία διατηρείται στις θέσεις ανταλλαγής κατιόντων εδάφους. Επιπλέον, παράγεται υδροξείδιο του αμμωνίου. Αυτές οι ενώσεις είναι πηγή αζώτου.
Μαζί με τον φώσφορο και το κάλιο, το άζωτο αποτελεί την τριάδα των βασικών θρεπτικών ουσιών των φυτών που είναι απαραίτητα για την ανάπτυξή της.
Αναφορές
- Ganong, W. F. (2002), Medical Physiology. 19η έκδοση. Σύντομο Σύγχρονο Εγχειρίδιο.
- Α. D. Fortes, J. Ρ. Brodholt, Ι. G. Wood, και L. Vocadlo. (2001). Ab initio προσομοίωση της μονοένυδρης αμμωνίας (NH3∙ H2Ο) και υδροξείδιο αμμωνίου (ΝΗ4ΟΗ). Αμερικανικό Ινστιτούτο Φυσικής. J. Chem. Phys., Τόμος 115, Νο. 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6 Φεβρουαρίου 2017). Στοιχεία υδροξειδίου του αμμωνίου. Ανακτήθηκε από: thoughtco.com
- Ομάδα Pochteca. (2015). Υδροξείδιο του αμμωνίου. pochteca.com.mx
- NJ Health (s.f.). Ενημερωτικό δελτίο για επικίνδυνες ουσίες: υδροξείδιο του αμμωνίου. [PDF] Ανακτήθηκε από: nj.gov
- Μαθητής Χημείας. (2018). Υδροξείδιο αμμωνίου. Ανακτήθηκε από: chemistrylearner.com
- PubChem. (2018). Υδροξείδιο αμμωνίου. Ανακτήθηκε από: pubchem.ncbi.nlm.nih.gov


