Τύποι και παραδείγματα μοριακής γεωμετρίας
Το μοριακή γεωμετρία o μοριακή δομή είναι η χωρική κατανομή των ατόμων γύρω από ένα κεντρικό άτομο. Τα άτομα αντιπροσωπεύουν περιοχές όπου υπάρχει υψηλή ηλεκτρονική πυκνότητα και ως εκ τούτου θεωρούνται ηλεκτρονικές ομάδες, ανεξάρτητα από τις συνδέσεις που σχηματίζουν (απλή, διπλή ή τριπλή).
Αυτή η έννοια προέρχεται από το συνδυασμό και των πειραματικών δεδομένων των δύο θεωριών: δεσμού σθένους (TEV) και απώθησης των ζευγών ηλεκτρονίων του κελύφους σθένους (VSEPR). Ενώ η πρώτη ορίζει τους συνδέσμους και τις γωνίες τους, ο δεύτερος καθορίζει τη γεωμετρία και επομένως τη μοριακή δομή.

Ποια γεωμετρικά σχήματα είναι μόρια ικανά να υιοθετήσουν; Οι δύο προηγούμενες θεωρίες παρέχουν τις απαντήσεις. Σύμφωνα με το VSEPR, τα άτομα και τα ζεύγη των ελεύθερων ηλεκτρονίων πρέπει να είναι διατεταγμένα στο χώρο με τέτοιο τρόπο ώστε να ελαχιστοποιούν την ηλεκτροστατική απώθηση μεταξύ τους..
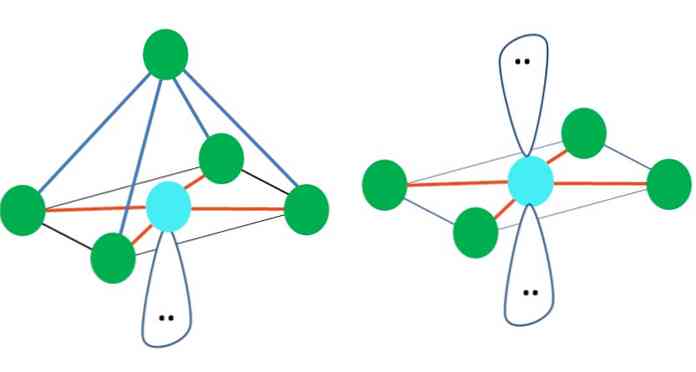
Έτσι, τα γεωμετρικά σχήματα δεν είναι αυθαίρετα, αλλά αναζητήστε τον πιο σταθερό σχεδιασμό. Για παράδειγμα, στην επάνω εικόνα ένα τρίγωνο μπορεί να δει προς τα αριστερά και ένα οκταεδρόν προς τα δεξιά. Οι πράσινες κουκίδες αντιπροσωπεύουν τα άτομα και τα πορτοκαλί ρίγες τους συνδέσμους.
Στο τρίγωνο, τα τρία πράσινα σημεία προσανατολίζονται σε χωρισμό 120º. Αυτή η γωνία, η οποία είναι ίση με αυτή του δεσμού, επιτρέπει στα άτομα να απωθούν ο ένας τον άλλον όσο το δυνατόν λιγότερο. Επομένως, ένα μόριο με ένα κεντρικό άτομο συνδεδεμένο με τρεις άλλους θα υιοθετήσει μια γεωμετρία τριγωνικού επιπέδου.
Ωστόσο, το VSCR προβλέπει ότι ένα ελεύθερο ζεύγος ηλεκτρονίων στο κεντρικό άτομο θα παραμορφώσει τη γεωμετρία. Για την περίπτωση του τριγωνικού επιπέδου, αυτό το ζεύγος θα ωθήσει προς τα κάτω τα τρία πράσινα σημεία, με αποτέλεσμα μια τριγωνική γεωμετρία πυραμίδων.
Το ίδιο μπορεί να συμβεί και με το οκτάεδδρο της εικόνας. Σε αυτό όλα τα άτομα χωρίζονται με τον πιο σταθερό τρόπο.
Ευρετήριο
- 1 Πώς να γνωρίζετε εκ των προτέρων τη μοριακή γεωμετρία ενός ατόμου Χ?
- 2 Τύποι
- 2.1 Γραμμική
- 2.2 Γωνιακό
- 2.3 Τετραεδρική
- 2.4 Τριγωνικό διπυραμίδιο
- 2.5 Οκταεδρικό
- 2.6 Άλλες μοριακές γεωμετρίες
- 3 Παραδείγματα
- 3.1 Γραμμική γεωμετρία
- 3.2 Γωνιακή γεωμετρία
- 3.3 Τριγωνικό σχέδιο
- 3.4 Τετραεδρική
- 3.5 Τριγωνική πυραμίδα
- 3,6 τριπλή Bipyramid
- 3.7 Ταλάντωση
- 3.8 Σχήμα του Τ
- 3.9 Οκταεδρικό
- 4 Αναφορές
Πώς να γνωρίζετε εκ των προτέρων τη μοριακή γεωμετρία ενός ατόμου Χ?
Γι 'αυτό, είναι απαραίτητο να θεωρήσουμε επίσης τα ζεύγη των ελεύθερων ηλεκτρονίων ως ηλεκτρονικές ομάδες. Αυτά, μαζί με τα άτομα, θα καθορίσουν αυτό που είναι γνωστό ως ηλεκτρονική γεωμετρία, η οποία είναι ένας αναπόσπαστος σύντροφος της μοριακής γεωμετρίας.
Από την ηλεκτρονική γεωμετρία, και έχοντας εντοπίσει από τη δομή Lewis τα ζεύγη των ελεύθερων ηλεκτρονίων, μπορούμε να καθορίσουμε τι θα είναι η μοριακή γεωμετρία. Το άθροισμα όλων των μοριακών γεωμετριών θα παρέχει ένα περίγραμμα της παγκόσμιας δομής.
Τύποι
Όπως φαίνεται στην κύρια εικόνα, η μοριακή γεωμετρία εξαρτάται από το πόσα άτομα περιβάλλουν το κεντρικό άτομο. Ωστόσο, αν υπάρχει ένα ζευγάρι ηλεκτρονίων χωρίς κοινή χρήση, θα αλλάξει η γεωμετρία επειδή καταλαμβάνει μεγάλη ένταση. Επομένως, ασκεί ένα στερικό αποτέλεσμα.
Σύμφωνα με αυτό, η γεωμετρία μπορεί να παρουσιάσει μια σειρά χαρακτηριστικών σχημάτων για πολλά μόρια. Και αυτό είναι όπου προκύπτουν διαφορετικοί τύποι μοριακής γεωμετρίας ή μοριακής δομής.
Πότε είναι η γεωμετρία ίση με τη δομή; Και οι δύο υποδηλώνουν το ίδιο μόνο στις περιπτώσεις όπου η δομή δεν έχει περισσότερους από έναν τύπους γεωμετρίας. διαφορετικά, όλοι οι παρόντες τύποι πρέπει να λαμβάνονται υπόψη και η δομή να έχει ένα παγκόσμιο όνομα (γραμμικό, διακλαδισμένο, σφαιρικό, επίπεδο, κ.λπ.).
Οι γεωμετρίες είναι ιδιαίτερα χρήσιμες για να εξηγήσουν τη δομή ενός στερεού από τις δομικές μονάδες του.
Γραμμική
Όλοι οι ομοιοπολικοί δεσμοί είναι κατευθυντικοί, οπότε ο κρίκος Α-Β είναι γραμμικός. Αλλά το μόριο ΑΒ θα είναι γραμμικό;2? Εάν ναι, η γεωμετρία αντιπροσωπεύεται απλά ως: Β-Α-Β. Τα δύο άτομα Β διαχωρίζονται με γωνία 180 °, και σύμφωνα με το TEV, το Α πρέπει να έχει υβ υβριδικά τροχιακά.
Γωνιακό
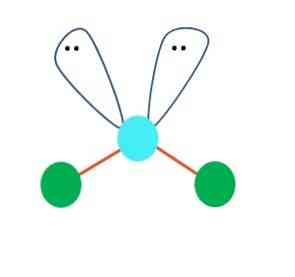
Μπορεί να θεωρηθεί σε πρώτη φάση μια γραμμική γεωμετρία για το μόριο ΑΒ2? Ωστόσο, είναι απαραίτητο να σχεδιάσουμε τη δομή του Lewis πριν καταλήξουμε σε ένα συμπέρασμα. Σχεδιάζοντας τη δομή του Lewis, μπορούμε να προσδιορίσουμε τον αριθμό των ζευγών ηλεκτρονίων χωρίς να μοιραστούμε (:) το άτομο του Α.
Όταν συμβαίνει αυτό, πάνω από τα ζεύγη ηλεκτρονίων ωθούν τα δύο άτομα του Β προς τα κάτω, αλλάζοντας τις γωνίες τους. Ως αποτέλεσμα, το γραμμικό μόριο Β-Α-Β καταλήγει να γίνει ένα V, ένα μπούμερανγκ ή μια γωνιακή γεωμετρία (κορυφαία εικόνα)
Το μόριο νερού, H-O-H, είναι το ιδανικό παράδειγμα για αυτόν τον τύπο γεωμετρίας. Στο άτομο οξυγόνου υπάρχουν δύο ζεύγη ηλεκτρονίων χωρίς κοινή χρήση τα οποία είναι προσανατολισμένα σε μια γωνία περίπου 109 °.
Γιατί αυτή η γωνία; Επειδή η ηλεκτρονική γεωμετρία είναι τετραεδρική, η οποία έχει τέσσερις κορυφές: δύο για άτομα Η και δύο για ηλεκτρόνια. Στην παραπάνω εικόνα σημειώστε ότι οι πράσινες κουκίδες και οι δύο "λοβοί με τα μάτια" σχεδιάζουν ένα τετράεδρο με το γαλαζωπό σημείο στο κέντρο του.
Εάν O δεν έχουν ελεύθερα ζεύγη ηλεκτρονίων, το νερό σχηματίζουν ένα γραμμικό μόριο, και να μειώσει τους ωκεανούς πολικότητα, θάλασσες, λίμνες, κλπ, μάλλον δεν θα υπάρχουν ως γνωστές.
Τετραεδρική
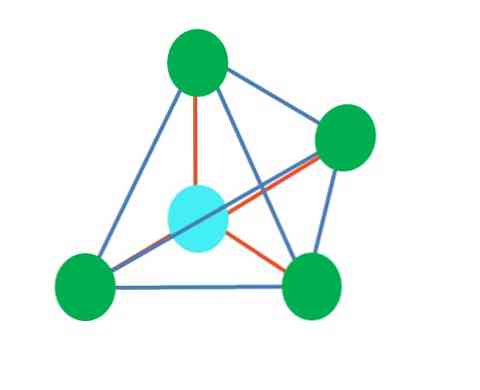
Η επάνω εικόνα αντιπροσωπεύει την τετραεδρική γεωμετρία. Για το μόριο του νερού, η ηλεκτρονική του γεωμετρία είναι τετραεδρική, αλλά με την εξάλειψη των ζευγών χωρίς ηλεκτρόνια μπορεί να παρατηρηθεί ότι μετασχηματίζεται σε γωνιακή γεωμετρία. Αυτό παρατηρείται επίσης απλά εξαλείφοντας δύο πράσινες κουκίδες. τα υπόλοιπα δύο θα τραβήξουν το V με τη μπλε κουκκίδα.
Τι γίνεται αν αντί δύο ζευγών ελεύθερων ηλεκτρονίων υπήρχε μόνο ένα; Τότε θα υπήρχε ένα τριγωνικό επίπεδο (κύρια εικόνα). Ωστόσο, εξαλείφοντας μια ηλεκτρονική ομάδα, το στερικό αποτέλεσμα που παράγεται από το ζεύγος των ελεύθερων ηλεκτρονίων δεν αποφεύγεται. Επομένως, παραμορφώνει το τριγωνικό επίπεδο σε μια τριγωνική πυραμίδα βάσης:

Αν και η μοριακή γεωμετρία της τριγωνικής και τετραεδρικής πυραμίδας είναι διαφορετική, η ηλεκτρονική γεωμετρία είναι η ίδια: τετραεδρική. Έτσι, η τριγωνική πυραμίδα δεν μετράει ως ηλεκτρονική γεωμετρία?
Η απάντηση είναι όχι, δεδομένου ότι είναι το αποτέλεσμα της στρέβλωσης που προκαλείται από τα «μάτια λοβού» και στερητικό αποτέλεσμα της, και ότι η γεωμετρία δεν λαμβάνει υπόψη τις μεταγενέστερες στρεβλώσεις.
Για το λόγο αυτό, είναι πάντα σημαντικό να προσδιοριστεί πρώτα η ηλεκτρονική γεωμετρία με τη βοήθεια των δομών του Lewis, προτού καθοριστεί η μοριακή γεωμετρία. Το μόριο αμμωνίας, NH3, είναι ένα παράδειγμα της μοριακής γεωμετρίας τριγωνικής πυραμίδας, αλλά με τετραεδρική ηλεκτρονική γεωμετρία.
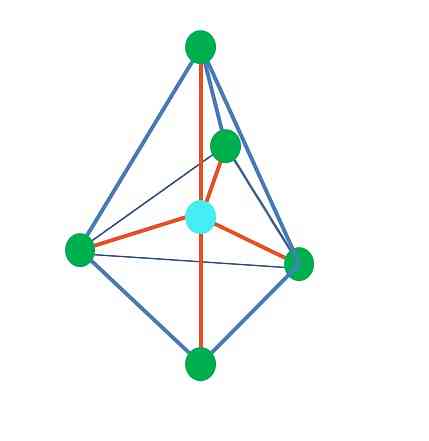
Τριγωνικό διραμιδαμίδιο
Μέχρι τώρα, με εξαίρεση τη γραμμική γεωμετρία, στην τετραεδρική, τη γωνιακή και την τριγωνική πυραμίδα τα κεντρικά της άτομα έχουν sp υβριδισμό3, σύμφωνα με το TEV. Αυτό σημαίνει ότι εάν οι γωνίες σύνδεσης καθορίστηκαν πειραματικά, θα πρέπει να είναι περίπου 109º.
Από την τριγωνική διπαραμιδική γεωμετρία υπάρχουν πέντε ηλεκτρονικές ομάδες γύρω από το κεντρικό άτομο. Στην πάνω εικόνα μπορείτε να δείτε με τα πέντε πράσινα σημεία. τρεις στην τριγωνική βάση και δύο σε αξονικές θέσεις, οι οποίες είναι οι άνω και κάτω κορυφές της πυραμίδας.
Τι υβριδοποίηση έχει η μπλε κουκίδα; Χρειάζεται πέντε υβριδικά τροχιακά για να σχηματίσουν τους απλούς δεσμούς (πορτοκαλί). Αυτό επιτυγχάνεται μέσα από τα πέντε orbitals3d (προϊόν του μείγματος ενός τροχιακού s, τριών p και a d).
Κατά την εξέταση πέντε ηλεκτρονικές ομάδες, η γεωμετρία είναι ήδη εκτεθειμένη, αλλά έχοντας επιμερισμένα ζεύγη ηλεκτρονίων, πάσχει πάλι στρεβλώσεις ότι άλλες γεωμετρίες. Επίσης, τίθεται το ακόλουθο ερώτημα: μπορούν αυτά τα ζεύγη να καταλάβουν οποιαδήποτε θέση στην πυραμίδα; Αυτά είναι: η αξονική ή η ισημερινή.
Αξονικές και ισημερινές θέσεις
Τα πράσινα σημεία που αποτελούν την τριγωνική βάση είναι σε θέσεις ισημερινών, ενώ τα δύο στο άνω και κάτω άκρο, σε αξονικές θέσεις. Όπου, κατά προτίμηση, θα βρίσκεται το ζεύγος ηλεκτρονίων χωρίς κοινή χρήση; Σε αυτή τη θέση που ελαχιστοποιεί την ηλεκτροστατική απώθηση και το στερικό αποτέλεσμα.
Αξονικά εντοπισμό του ζεύγους ηλεκτρονίων θα «πίεση» κάθετος (90) σχετικά με την τριγωνική βάση, ενώ αν στην ισημερινή θέση, οι δύο υπόλοιπες ηλεκτρονικές ομάδες της βάσης θα είναι 120 ° εκτός και θα πιέσει τα δύο άκρα 90 ° (αντί της τρεις, όπως με τη βάση).
Επομένως, το κεντρικό άτομο θα επιδιώξει να προσανατολίσει τα ζεύγη του χωρίς ηλεκτρόνια στις ισημερινές θέσεις για να δημιουργήσει πιο σταθερές μοριακές γεωμετρίες.
Ταλαντευόμενο και Τ σχήμα
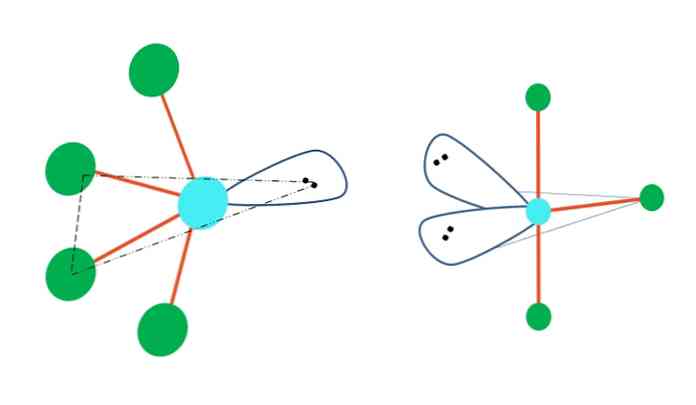
Εάν η τριγωνική γεωμετρία διπυραμίδης αντικαθιστούσε ένα ή περισσότερα από τα άτομα της με ζεύγη χωρίς ηλεκτρόνια, θα είχε διαφορετικές μοριακές γεωμετρίες.
Στα αριστερά της κορυφαίας εικόνας, η γεωμετρία αλλάζει στο ταλαντευόμενο σχήμα. Σε αυτό, το ελεύθερο ζεύγος ηλεκτρονίων ωθεί τα υπόλοιπα από τα τέσσερα άτομα προς την ίδια κατεύθυνση, διπλώντας τους συνδέσμους προς τα αριστερά. Σημειώστε ότι αυτό το ζεύγος και δύο από τα άτομα βρίσκονται στο ίδιο τριγωνικό επίπεδο του αρχικού διπυραμιδίου.
Και η δεξιά της εικόνας, το σχήματος Τ γεωμετρία Αυτό μοριακή γεωμετρία είναι το αποτέλεσμα της αντικατάστασης δύο άτομα από δύο ζεύγη ηλεκτρονίων, κατά συνέπεια, με αποτέλεσμα τα υπόλοιπα τρία άτομα είναι ευθυγραμμισμένες στο ίδιο επίπεδο, που σχηματίζουν ακριβώς ένα γράμμα Τ.
Έτσι, για ένα μόριο τύπου ΑΒ5, υιοθετεί τριγωνική γεωμετρία διπυραμίδης. Ωστόσο, AB4, με την ίδια ηλεκτρονική γεωμετρία, θα υιοθετήσει την ταλαντευόμενη γεωμετρία. και ΑΒ3, τη γεωμετρία σχήματος Τ. Σε όλα αυτά, το Α θα έχει (γενικά) υβ υβριδισμό3δ.
Για να προσδιοριστεί η μοριακή γεωμετρία είναι απαραίτητο να σχεδιαστεί η δομή Lewis και επομένως η ηλεκτρονική της γεωμετρία. Αν πρόκειται για τριπλή διπυραμίδη, τότε τα ζεύγη χωρίς ηλεκτρόνια θα απορριφθούν, αλλά όχι τα στερεοχημικά τους αποτελέσματα στα υπόλοιπα άτομα. Έτσι, είναι δυνατόν να διακριθεί τέλεια μεταξύ των τριών πιθανών μοριακών γεωμετριών.
Οκταεδρικό
Η οκταεδρική μοριακή γεωμετρία απεικονίζεται στα δεξιά της κύριας εικόνας. Αυτός ο τύπος γεωμετρίας αντιστοιχεί στις ενώσεις ΑΒ6. ΑΒ4 σχηματίζουν την τετραγωνική βάση, ενώ τα υπόλοιπα δύο Β τοποθετούνται σε αξονικές θέσεις. Έτσι, σχηματίζονται αρκετά ισόπλευρα τρίγωνα, τα οποία είναι τα πρόσωπα του οκταεδρόντος.
Εδώ, πάλι, μπορεί να υπάρχουν (όπως σε όλες τις ηλεκτρονικές γεωμετρίες) ελεύθερα ζεύγη ηλεκτρονίων και συνεπώς άλλες μοριακές γεωμετρίες προέρχονται από αυτό το γεγονός. Για παράδειγμα, AB5 με οκταεδρική ηλεκτρονική γεωμετρία αποτελείται από μια πυραμίδα με τετραγωνική βάση και ΑΒ4 ενός τετραγωνικού επιπέδου:
Για την περίπτωση της οκταεδρικής ηλεκτρονικής γεωμετρίας, αυτές οι δύο μοριακές γεωμετρίες είναι οι πιο σταθερές όσον αφορά την ηλεκτροστατική απώθηση. Στην πλατεία-επίπεδη γεωμετρία, τα δύο ζεύγη ηλεκτρονίων είναι 180 ° μεταξύ τους.
Ποια είναι η υβριδοποίηση του ατόμου Α σε αυτές τις γεωμετρίες (ή δομές, αν είναι η μόνη); Και πάλι, το TEV διαπιστώνει ότι είναι sp3δ2, έξι υβριδικά τροχιακά, τα οποία επιτρέπουν στο Α να προσανατολίσουν τις ηλεκτρονικές ομάδες στις κορυφές ενός οκταεδρίου.
Άλλες μοριακές γεωμετρίες
Με την τροποποίηση των βάσεων των πυραμίδων που αναφέρονται μέχρι τώρα, μπορούν να ληφθούν κάποιες πιο πολύπλοκες μοριακές γεωμετρίες. Για παράδειγμα, το πενταγωνικό διπυραμίδιο βασίζεται σε ένα πεντάγωνο και οι ενώσεις που το σχηματίζουν έχουν έναν γενικό τύπο AB7.
Όπως και οι άλλες μοριακές γεωμετρίες, υποκαθιστώντας τα άτομα Β για ζευγάρια χωρίς ηλεκτρόνια θα παραμορφώσει τη γεωμετρία σε άλλες μορφές.
Επίσης, οι ενώσεις ΑΒ8 μπορούν να υιοθετήσουν γεωμετρίες όπως το τετράγωνο αντιπρίσμα. Ορισμένες γεωμετρίες μπορεί να είναι πολύ περίπλοκες, ειδικά για τους τύπους ΑΒ7 (έως το ΑΒ12).
Παραδείγματα
Στη συνέχεια, θα αναφερθεί μία σειρά ενώσεων για κάθε μία από τις κύριες μοριακές γεωμετρίες. Ως άσκηση, θα μπορούσατε να σχεδιάσετε τις δομές Lewis για όλα τα παραδείγματα και να πιστοποιήσετε εάν, λαμβάνοντας υπόψη την ηλεκτρονική γεωμετρία, θα έχετε τις μοριακές γεωμετρίες όπως αναφέρονται παρακάτω..
Γραμμική γεωμετρία
-Αιθυλένιο, Η2C≡CH2
-Χλωριούχο βηρύλλιο, BeCl2 (Cl-Be-Cl)
-Διοξείδιο του άνθρακα, CO2 (Ο = C = O)
-Άζωτο, Ν2 (N≡N)
-Διβρωμιούχο υδράργυρο, HgBr2 (Br-Hg-Br)
-Τριωδίδιο ανιόντος, Ι3- (Ι-Ι-Ι)
-Κυανιούχο υδρογόνο, HCN (H-N = C)
Οι γωνίες του πρέπει να είναι 180º και επομένως να έχουν υβριδισμό sp.
Γωνιακή γεωμετρία
-Το νερό
-Διοξείδιο του θείου, SO2
-Διοξείδιο του αζώτου, ΝΟ2
-Όζον, Ω3
-Ανιόν αμιδούρο, ΝΗ2-
Τριγωνικό αεροπλάνο
-Τριφθοριούχο βρώμιο, BF3
-Τριχλωριούχο αργίλιο, AlCl3
-Νιτρικό ανιόν, ΝΟ3-
-Ανθρακικό ανιόν, CO32-
Τετραεδρική
-Μεθανόλη, CH4
-Τετραχλωριούχος άνθρακας, CCl4
-Κατιον αμμωνίου, ΝΗ4+
-Θειικό ανιόν, SO42-
Τριγωνική πυραμίδα
-Αμμωνία, ΝΗ3
-Κατιονδρογόνο, Η3Ο+
Τριγωνικό διραμιδαμίδιο
-Πενταφθοριούχο φωσφόρο, PF5
-Πενταχλωριούχο αντιμόνιο, SbF5
Ταλαντεύεται
Τετραφθοριούχο θείο, SF4
Σχήμα του Τ
-Τριχλωριούχο ιώδιο, ICI3
-Τριφθοριούχο χλωρίδιο, ClF3 (αμφότερες οι ενώσεις είναι γνωστές ως δια-αλογόνα)
Οκταεδρικό
-Εξαφθοριούχο θείο, SF6
-Εξαφθοριούχο σελήνιο, SeF6
-Εξαφθοροφωσφορικό, PF6-
Για να κορυφωθεί, η μοριακή γεωμετρία εξηγεί τις παρατηρήσεις των χημικών ή φυσικών ιδιοτήτων της ύλης. Ωστόσο, είναι προσανατολισμένη σύμφωνα με την ηλεκτρονική γεωμετρία, έτσι ώστε η τελευταία πρέπει πάντα να προσδιορίζεται πριν από την πρώτη.
Αναφορές
- Whitten, Davis, Peck & Stanley. Χημεία (8η έκδοση). CENGAGE Learning, σελ. 194-198.
- Shiver & Atkins. (2008). Ανόργανη χημεία (Τέταρτη έκδοση, σελ. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Η μοριακή γεωμετρία και η θεωρία VSEPR. Ανακτήθηκε από: nyu.edu
- Virtual Chembook, Charles Ε. Ophardt. (2003). Εισαγωγή στη Μοριακή Γεωμετρία. Ανακτήθηκε από: chemistry.elmhurst.edu
- Χημεία LibreTexts. (8 Σεπτεμβρίου 2016). Γεωμετρία των μορίων. Ανακτήθηκε από: chem.libretexts.org


