Τύποι κητών, ιδιότητες, ονοματολογία, χρήσεις και παραδείγματα
Το κετόνες είναι οργανικές ενώσεις που διαθέτουν μια ομάδα καρβονυλίου (-CO). Είναι απλές ενώσεις στις οποίες ο άνθρακας της ομάδας καρβονυλίου συνδέεται με δύο άτομα άνθρακα (και τις αλυσίδες υποκαταστάσεών τους). Οι κετόνες είναι "απλές" επειδή δεν έχουν δραστικές ομάδες όπως -ΟΗ ή -Cl συνδεδεμένες με άνθρακα.
Τέλος, η απομάκρυνση των κετονών του ανθρώπινου σώματος είναι συχνά συνδέεται με χαμηλά επίπεδα σακχάρου στο αίμα (διαβητική ή / και γρήγορη ακραίες περιπτώσεις), η οποία μπορεί να προκαλέσει σοβαρά προβλήματα υγείας για τον ασθενή.
Ευρετήριο
- 1 Γενικός τύπος κετονών
- 2 Τύποι κετονών
- 2.1 Σύμφωνα με τη δομή της αλυσίδας σας
- 2.2 Σύμφωνα με τη συμμετρία των ριζοσπαστών της
- 2.3 Σύμφωνα με τον κορεσμό των ριζών της
- 2.4 Δικετόνες
- 3 Φυσικές και χημικές ιδιότητες των κετονών
- 3.1 Σημείο ζέσεως
- 3.2 Διαλυτότητα
- 3.3 Οξύτητα
- 3.4 Δραστικότητα
- 4 Ονοματολογία
- 5 Διαφορά μεταξύ αλδεϋδών και κετονών
- 6 Βιομηχανική και καθημερινή χρήση
- 7 Παραδείγματα κετονών
- 7.1 βουτανόνη (C4H8O)
- 7.2 Κυκλοεξανόνη (C6H10O)
- 7.3 Τεστοστερόνη (C19H22O2)
- 7.4 Προγεστερόνη (C21H30O2)
- 8 Αναφορές
Γενικός τύπος κετονών
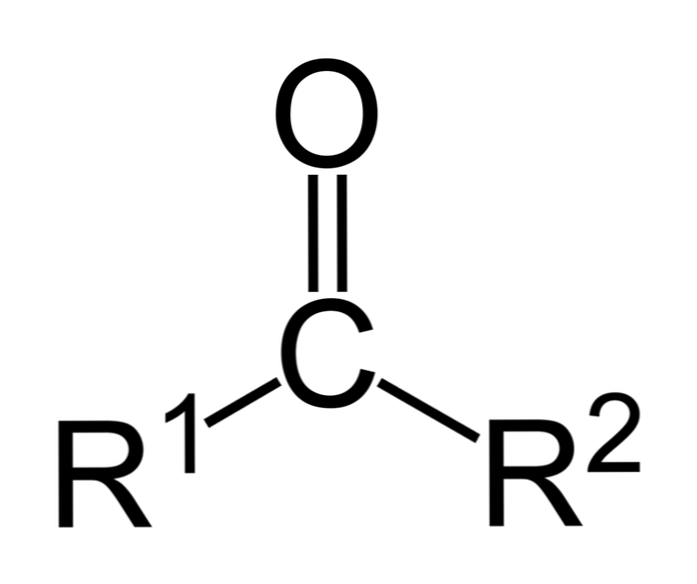
Οι κετόνες είναι ενώσεις καρβονυλίου στις οποίες αυτή η ομάδα δεσμεύεται σε δύο υδρογονανθρακικές ομάδες. αυτές μπορεί να είναι ομάδες αλκυλίου, ομάδες δακτυλίου βενζολίου ή αμφότερες.
Μία κετόνη μπορεί να παρασταθεί απλά ως R- (C = O) -R «όπου R και R» είναι είτε δύο αλυσίδες υδρογονανθράκων (αλκάνια, αλκένια, αλκύνια, κυκλοαλκάνια, παράγωγα βενζολίου και άλλοι). Δεν υπάρχουν κετόνες με υδρογόνο συνδεδεμένο στην ομάδα καρβονυλίου.
Υπάρχει μια ευρεία ποικιλία μεθόδων για την παρασκευή κετονών στο βιομηχανικό και εργαστηριακό περιβάλλον. Επιπλέον, είναι σημαντικό να σημειωθεί ότι οι κετόνες μπορούν να συντεθούν από διαφορετικούς οργανισμούς, συμπεριλαμβανομένων των ανθρώπων.
Στη βιομηχανία, η συνηθέστερη μέθοδος για τη σύνθεση κετονών περιλαμβάνει την οξείδωση των υδρογονανθράκων, τυπικά με τη χρήση του αέρα. Σε μικρή κλίμακα, οι κετόνες συνήθως παρασκευάζονται μέσω της οξείδωσης δευτεροταγών αλκοολών, οι οποίες δίνουν ως προϊόντα κετόνη και νερό.
Πέρα από αυτές τις πιο κοινές μεθόδους, οι κετόνες μπορούν να συντεθούν μέσω αλκενίων, αλκυνών, αλάτων αζωτούχων ενώσεων, εστέρων και πολλών άλλων ενώσεων, πράγμα που τους καθιστά εύκολο να αποκτήσουν.
Τύποι κετονών
Υπάρχουν αρκετές ταξινομήσεις για τις κετόνες, ανάλογα κυρίως με τους υποκαταστάτες στις αλυσίδες τους R. Οι πιο κοινές ταξινομήσεις για τις ουσίες αυτές είναι:
Σύμφωνα με τη δομή της αλυσίδας σας
Στην περίπτωση αυτή, η κετόνη έχει χαρακτηριστεί από τον τρόπο με τον οποίο δομείται αλυσίδας: αλειφατικές κετόνες είναι εκείνες με δύο R και R «έχουν ρίζες αλκυλίου σχηματίζουν (αλκάνια, αλκένια, αλκύνια και κυκλοαλκάνια).
Από την πλευρά της, τα αρωματικά είναι αυτά που σχηματίζουν παράγωγα βενζολίου, ενώ εξακολουθούν να είναι κετόνες. Τέλος, μικτές κετόνες είναι αυτές που έχουν ρίζα αλκυλίου R και ρίζα R 'αρυλίου, ή αντίστροφα.
Σύμφωνα με τη συμμετρία των ριζοσπαστών της
Στην περίπτωση αυτή μελετώνται οι υποκαταστάτες της ρίζας R και R 'της ομάδας καρβονυλίου. όταν αυτά είναι ίσα (πανομοιότυπα), η κετόνη ονομάζεται συμμετρική. αλλά όταν είναι διαφορετικές (όπως οι περισσότερες κετόνες), αυτό ονομάζεται ασύμμετρη.
Σύμφωνα με τον κορεσμό των ριζών του
Οι κετόνες μπορούν επίσης να ταξινομηθούν ανάλογα με τον κορεσμό των αλυσίδων άνθρακα τους. Εάν αυτά είναι υπό τη μορφή αλκανίων, η κετόνη ονομάζεται κορεσμένη κετόνη. Αντιθέτως, αν οι αλυσίδες βρίσκονται ως αλκένια ή αλκύνια, η κετόνη ονομάζεται ακόρεστη κετόνη.
Dicetones
Αυτή είναι μια ξεχωριστή κατηγορία κετόνης, αφού οι αλυσίδες της κετόνης αυτής έχουν δύο δομές καρβονυλίου στη δομή τους. Ορισμένες από αυτές τις κετόνες έχουν μοναδικά χαρακτηριστικά, όπως μεγαλύτερο μήκος δεσμού μεταξύ ανθράκων.
Για παράδειγμα, οι δικετόνες που προέρχονται από κυκλοεξάνιο είναι γνωστές ως κινόνες, οι οποίες είναι μόνο δύο: ορθο-βενζοκινόνη και παρα-βενζοκινόνη.
Φυσικές και χημικές ιδιότητες των κετονών
Οι κετόνες, όπως και οι περισσότερες αλδεΰδες, είναι υγρά μόρια και έχουν μια σειρά φυσικών και χημικών ιδιοτήτων που ποικίλλουν ανάλογα με το μήκος των αλυσίδων τους. Οι ιδιότητές του περιγράφονται παρακάτω:
Σημείο ζέσεως
Οι κετόνες είναι πολύ πτητικά, ουσιαστικά πολικές και δεν μπορούν να δωρίσουν υδρογόνου σε δεσμούς υδρογόνου (δεν κατέχουν άτομα υδρογόνου που συνδέονται με την ομάδα καρβονυλίου), έτσι ώστε παρούσα σημεία των υψηλότερων αλκενίων και αιθέρες βρασμού, αλλά χαμηλότερο από αλκοόλες του ίδιου μοριακού βάρους.
Το σημείο βρασμού μιας κετόνης αυξάνεται καθώς το μέγεθος του μορίου αυξάνεται. Αυτό οφείλεται στην παρέμβαση των van der Waals και των δυνάμεων διπόλης-διπόλης, που καθιστούν αναγκαία μια μεγαλύτερη ποσότητα ενέργειας για τον διαχωρισμό των ατόμων και των ηλεκτρονίων που προσελκύονται μέσα στο μόριο.
Διαλυτότητα
Η διαλυτότητα των κετονών έχει μια ισχυρή επίδραση στην ικανότητα αυτών των μορίων να δεχθεί τα υδρογόνα σε άτομο οξυγόνου του και έτσι σχηματίζουν δεσμό υδρογόνου με το νερό. Επιπλέον, σχηματίζονται ελκυστικές, διασκορπιστικές και διπολικές διπολικές δυνάμεις μεταξύ κετονών και νερού, οι οποίες αυξάνουν το διαλυτό τους αποτέλεσμα.
Οι κετόνες χάνουν την ικανότητα διαλυτότητας τόσο μεγαλύτερο είναι το μόριο τους, καθώς αρχίζουν να απαιτούν περισσότερη ενέργεια για να διαλυθούν στο νερό. Είναι επίσης διαλυτά σε οργανικές ενώσεις.
Οξύτητα
Χάρη στην ομάδα καρβονυλίου, οι κετόνες έχουν όξινη φύση. αυτό συμβαίνει λόγω της ικανότητας σταθεροποίησης συντονισμού αυτής της λειτουργικής ομάδας, η οποία μπορεί να μεταφέρει πρωτόνια από τον διπλό δεσμό της για να σχηματίσει μια συζευγμένη βάση που ονομάζεται enol.
Δραστικότητα
Οι κετόνες αποτελούν μέρος μεγάλου αριθμού οργανικών αντιδράσεων. αυτό συμβαίνει λόγω της ευαισθησίας του καρβονυλικού άνθρακα στην πυρηνόφιλη προσθήκη, εκτός από την πολικότητα αυτού.
Όπως αναφέρθηκε παραπάνω, η υψηλή αντιδραστικότητα των κετονών τα καθιστά ένα αναγνωρισμένο ενδιάμεσο προϊόν το οποίο χρησιμεύει ως βάση για τη σύνθεση άλλων ενώσεων.
Ονοματολογία
Οι κετόνες ονομάζονται σύμφωνα με την προτεραιότητα ή σημασία του καρβονυλίου σε ολόκληρο το μόριο, έτσι ώστε όταν ένα μόριο διέπεται από την ομάδα καρβονυλίου, η κετόνη ονομάζεται προσθέτοντας την κατάληξη «-όνη» το όνομα του υδρογονάνθρακα.
Η μακρύτερη αλυσίδα με την ομάδα καρβονυλίου λαμβάνεται ως η κύρια αλυσίδα και στη συνέχεια ονομάζεται το μόριο. Εάν η ομάδα καρβονυλίου δεν έχει προτεραιότητα έναντι των άλλων λειτουργικών ομάδων του μορίου, τότε ταυτοποιείται με "-οξο".
Για πιο περίπλοκες κετόνες, η θέση της λειτουργικής ομάδας μπορεί να ταυτοποιηθεί με έναν αριθμό και στην περίπτωση των δικετονών (κετόνες με δύο πανομοιότυπους υποκαταστάτες R και R '), ονομάζεται το μόριο με την κατάληξη "-διόνη"..
Τέλος, η λέξη "κετόνη" μπορεί επίσης να χρησιμοποιηθεί μετά την αναγνώριση των αλυσίδων των ριζών που συνδέονται με τη λειτουργική ομάδα καρβονυλίου.
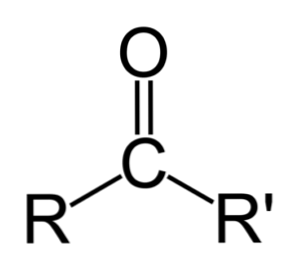
Διαφορά μεταξύ αλδεϋδών και κετονών
Η μεγαλύτερη διαφορά μεταξύ αλδεϋδών και κετονών είναι η παρουσία ατόμου υδρογόνου προσαρτημένου στην ομάδα καρβονυλίου στις αλδεΰδες.
Αυτό το άτομο έχει σημαντικό αποτέλεσμα όταν πρόκειται για τη συμμετοχή ενός μορίου σε μια αντίδραση οξείδωσης: μια αλδεΰδη θα σχηματίσει ένα καρβοξυλικό οξύ ή ένα άλας καρβοξυλικού οξέος, ανάλογα με το αν η οξείδωση συμβαίνει υπό όξινες ή βασικές συνθήκες.
Αντιθέτως, μια κετόνη δεν έχει αυτό το υδρογόνο, έτσι δεν συμβαίνουν τα ελάχιστα απαραίτητα στάδια για την οξείδωση.
Υπάρχουν μέθοδοι για την οξείδωση μίας κετόνης (με πολύ πιο ισχυρό από ό, τι εκείνα που χρησιμοποιούνται τυπικά οξειδωτικοί παράγοντες), αλλά αυτές σπάσει το μόριο κετόνη, διαχωρίζοντας πρώτα σε δύο ή περισσότερα μέρη.
Η βιομηχανική και καθημερινή ζωή χρησιμοποιεί
Στη βιομηχανία παρατηρούνται συχνά κετόνες στα αρώματα και τα χρώματα, λαμβάνοντας ρόλους σταθεροποιητών και συντηρητικών που εμποδίζουν την αποδόμηση άλλων συστατικών του μείγματος. έχουν επίσης ένα ευρύ φάσμα ως διαλύτες σε εκείνες τις βιομηχανίες που παράγουν εκρηκτικά, χρώματα και υφάσματα, εκτός από τα φαρμακευτικά προϊόντα.
Η ακετόνη (η μικρότερη και απλούστερη κετόνη) είναι ένας διαλύτης αναγνωρισμένος παγκοσμίως και χρησιμοποιείται ως αφαίρεσης χρωμάτων και λεπτότερο.
Στη φύση, οι κετόνες μπορούν να εμφανίζονται ως σάκχαρα, που ονομάζονται κετόζες. Οι κετόζες είναι μονοσακχαρίτες που περιέχουν μία κετόνη ανά μόριο. Η πιο γνωστή κετόζη είναι η φρουκτόζη, η ζάχαρη που βρίσκεται στα φρούτα και το μέλι.
Η βιοσύνθεση λιπαρών οξέων που συμβαίνει στο κυτταρόπλασμα των ζωικών κυττάρων συμβαίνει επίσης μέσω της δράσης των κετονών. Τέλος, και όπως αναφέρθηκε παραπάνω, μπορεί να υπάρξει αύξηση των κετονών στο αίμα μετά από νηστεία ή σε περιπτώσεις διαβητικών.
Παραδείγματα κετονών
Βουτανόνη (C4H8Ο)
Επίσης γνωστό ως MEK (ή MEC), το υγρό αυτό παράγεται σε μεγάλη κλίμακα στη βιομηχανία και χρησιμοποιείται ως διαλύτης.
Κυκλοεξανόνη (C6H10Ο)
Παράγεται σε τεράστια κλίμακα, αυτή η κετόνη χρησιμοποιείται ως πρόδρομος στο συνθετικό νάιλον υλικό.
Η τεστοστερόνη (C.19H22Ο2)
Είναι η κύρια ορμόνη του αρσενικού φύλου και ένα αναβολικό στεροειδές, που βρίσκεται στα περισσότερα σπονδυλωτά.
Η προγεστερόνη (C.21H30Ο2)
Ενδογενές στεροειδές και ορμόνες φύλου που εμπλέκονται στον έμμηνο κύκλο, εγκυμοσύνη και εμβρυογένεση σε ανθρώπους και άλλα είδη.
Αναφορές
- Wikipedia. (s.f.). Κετόνη Ανακτήθηκε από en.wikipedia.org
- Britannica, Ε. (S.f.). Κετόνη Ανακτήθηκε από britannica.com
- University, Μ. S. (s.f.). Αλδεϋδες και κετόνες. Ανακτήθηκε από chemistry.msu.edu
- ChemGuide. (s.f.). Εισαγωγή αλδεϋδών και κετονών. Ανακτήθηκε από το chemguide.co.uk
- Calgary, U.O. (s.f.). Κετόνες. Ανακτήθηκε από το chem.ucalgary.ca


