Εξισορρόπηση μεθόδων και παραδειγμάτων χημικών εξισώσεων
Το εξισορρόπηση των χημικών εξισώσεων υποδηλώνει ότι όλα τα στοιχεία που υπάρχουν στην εν λόγω εξίσωση έχουν τον ίδιο αριθμό ατόμων σε κάθε πλευρά. Για να επιτευχθεί αυτό, είναι αναγκαίο να χρησιμοποιήσει μεθόδους εξισορρόπησης για την κατανομή κατάλληλη στοιχειομετρική συντελεστές για κάθε είδος που υπάρχουν στην αντίδραση.
Μια χημική εξίσωση είναι η αναπαράσταση, μέσω συμβόλων, αυτού που συμβαίνει κατά τη διάρκεια μιας χημικής αντίδρασης μεταξύ δύο ή περισσοτέρων ουσιών. Τα αντιδραστήρια αλληλεπιδρούν μεταξύ τους και, ανάλογα με τις συνθήκες αντίδρασης, μία ή περισσότερες διαφορετικές ενώσεις θα ληφθούν ως προϊόν..
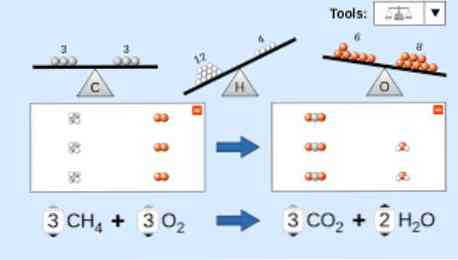
Όταν θα πρέπει να λαμβάνεται υπόψη μια χημική εξίσωση που περιγράφεται: Οι πρώτες ουσίες αντιδραστήριο γραμμένο στην αριστερή πλευρά της εξίσωσης, που ακολουθείται από ένα μονής κατεύθυνσης βέλος ή δύο απέναντι οριζόντια βέλη, ανάλογα με τον τύπο της αντίδρασης που πρόκειται να διεξαχθεί ακρωτήριο.
Ευρετήριο
- 1 Μέθοδοι εξισορρόπησης των χημικών εξισώσεων
- 1.1 Ισορροπία των χημικών εξισώσεων με δοκιμασία και σφάλμα (που ονομάζεται επίσης με επιθεώρηση ή δοκιμή)
- 1.2 Αλγεβρική εξισορρόπηση χημικών εξισώσεων
- 1.3 Κύλιση των οξειδοαναγωγικών εξισώσεων (μέθοδος ιόντων-ηλεκτρονίων)
- 2 Παραδείγματα χημικών εξισώσεων εξισορρόπησης
- 2.1 Πρώτο παράδειγμα
- 2.2 Δεύτερο παράδειγμα
- 2.3 Τρίτο παράδειγμα
- 3 Αναφορές
Μέθοδοι εξισορρόπησης χημικών εξισώσεων
Λαμβάνοντας ως βάση ότι τα αντιδραστήρια και τα προϊόντα είναι γνωστά και ότι οι τύποι τους εκφράζονται σωστά στην πλευρά που τους αντιστοιχεί, προχωρούμε στην εξισορρόπηση των εξισώσεων σύμφωνα με τις ακόλουθες μεθόδους.
Εξισορρόπηση των χημικών εξισώσεων με δοκιμασία και λάθος (που ονομάζεται επίσης με επιθεώρηση ή δοκιμή)
Βασίζεται στην στοιχειομετρία της αντίδρασης και προσπαθεί να δοκιμάσει με διαφορετικούς συντελεστές προκειμένου να ισορροπήσει την εξίσωση, όσο επιλέγονται οι μικρότεροι δυνατοί αριθμοί με τους οποίους ο ίδιος αριθμός ατόμων κάθε στοιχείου λαμβάνεται και στις δύο πλευρές της αντίδρασης.
Ο συντελεστής ενός αντιδραστηρίου ή ενός προϊόντος είναι ο αριθμός που προηγείται του τύπου του και είναι ο μόνος αριθμός που μπορεί να αλλάξει όταν εξισορροπείται μια εξίσωση, αφού η αλλαγή των υποδεικτών των τύπων θα άλλαζε την ταυτότητα της ένωσης εν λόγω ερώτηση.
Καταμέτρηση και σύγκριση
Αφού εντοπίσουμε κάθε στοιχείο της αντίδρασης και το τοποθετήσουμε στη σωστή πλευρά, συνεχίζουμε να μετράμε και να συγκρίνουμε τον αριθμό των ατόμων κάθε στοιχείου που υπάρχει στην εξίσωση και να καθορίσουμε αυτά που πρέπει να εξισορροπηθούν.
Στη συνέχεια, συνεχίζουμε με την εξισορρόπηση κάθε στοιχείου (ένα κάθε φορά), τοποθετώντας ολόκληρους συντελεστές πριν από κάθε τύπο που περιέχει μη ισορροπημένα στοιχεία. Συνήθως τα μεταλλικά στοιχεία ισορροπούν πρώτα, τότε τα μη μεταλλικά στοιχεία και τέλος τα άτομα οξυγόνου και υδρογόνου.
Κατ 'αυτόν τον τρόπο, κάθε συντελεστής πολλαπλασιάζει όλα τα άτομα του προηγούμενου τύπου. οπότε ενώ εξισορροπείται ένα στοιχείο, οι άλλοι μπορούν να αποσταθεροποιηθούν, αλλά αυτό διορθώνεται καθώς η αντίδραση είναι ισορροπημένη.
Τέλος, επιβεβαιώνεται από μια τελευταία μέτρηση ότι ολόκληρη η εξίσωση είναι σωστά ισορροπημένη, δηλαδή ότι υπακούει στον νόμο της διατήρησης της ύλης.
Αλγεβρική εξισορρόπηση των χημικών εξισώσεων
Για να χρησιμοποιήσουμε αυτή τη μέθοδο, δημιουργείται μια διαδικασία για την αντιμετώπιση των συντελεστών των χημικών εξισώσεων ως άγνωστων στοιχείων του συστήματος που πρέπει να λυθούν..
Πρώτον, ένα συγκεκριμένο στοιχείο της αντίδρασης λαμβάνεται ως αναφορά και οι συντελεστές τοποθετούνται ως γράμματα (a, b, c, d ...), τα οποία αντιπροσωπεύουν τα άγνωστα, σύμφωνα με τα υπάρχοντα άτομα αυτού του στοιχείου σε κάθε μόριο (εάν ένα είδος δεν περιέχει αυτό το στοιχείο τοποθετείται "0").
Αφού ληφθεί αυτή η πρώτη εξίσωση, προσδιορίζονται οι εξισώσεις για τα άλλα στοιχεία που υπάρχουν στην αντίδραση. θα υπάρχουν όσες εξισώσεις υπάρχουν στην εν λόγω αντίδραση.
Τέλος, τα άγνωστα προσδιορίζονται από μία από τις αλγεβρικές μεθόδους μείωσης, εξισορρόπησης ή υποκατάστασης και επιτυγχάνονται οι συντελεστές που οδηγούν στην σωστά ισορροπημένη εξίσωση.
Εξισορρόπηση εξισώσεων οξειδοαναγωγής (μέθοδος ιόντων-ηλεκτρονίων)
Αρχικά η γενική (μη ισορροπημένη) αντίδραση τοποθετείται στην ιοντική της μορφή. Στη συνέχεια, η εξίσωση αυτή χωρίζεται σε δύο μισές αντιδράσεις, την οξείδωση και τη μείωση, κάθε εξισορρόπηση ανάλογα με τον αριθμό των ατόμων, τον τύπο τους και τα φορτία αυτών.
Για παράδειγμα, για τις αντιδράσεις που εμφανίζονται σε όξινο περιβάλλον, προστίθενται μόρια Η.2Ή για να εξισορροπήσουμε τα άτομα οξυγόνου και να προσθέσουμε το Η+ για την εξισορρόπηση των ατόμων υδρογόνου.
Αντίθετα, σε ένα αλκαλικό μέσο προστίθεται ένας ίσος αριθμός ιόντων ΟΗ- στις δύο πλευρές της εξίσωσης για κάθε ιόν Η+, και όπου προκύπτουν ιόντα Η+ και OH- έρχονται μαζί για να σχηματίσουν μόρια Η2Ο.
Προσθέστε ηλεκτρόνια
Στη συνέχεια, πρέπει να προσθέσετε όσα ηλεκτρόνια είναι απαραίτητα για την εξισορρόπηση των φορτίων μετά την εξισορρόπηση της ύλης σε κάθε μισή αντίδραση.
Μετά την κύλιση κάθε μισής αντίδρασης, αυτά προστίθενται και κορυφώνονται με εξισορρόπηση της τελικής εξίσωσης με δοκιμή και σφάλμα. Σε περίπτωση που υπάρχει μια διαφορά στον αριθμό των ηλεκτρονίων των δύο μισών αντιδράσεων, ο ένας ή και τα δύο πρέπει να πολλαπλασιάζονται με έναν συντελεστή ίσο με αυτόν τον αριθμό.
Τέλος, πρέπει να επιβεβαιωθεί ότι η εξίσωση περιλαμβάνει τον ίδιο αριθμό ατόμων και τον ίδιο τύπο ατόμων, εκτός από το ότι έχουν τα ίδια φορτία και στις δύο πλευρές της παγκόσμιας εξίσωσης.
Παραδείγματα χημικών εξισώσεων εξισορρόπησης
Πρώτο παράδειγμα
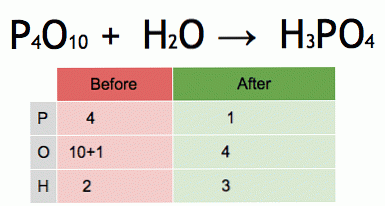
Αυτή είναι μια κίνηση μιας ισορροπημένης χημικής εξίσωσης. Το πεντοξείδιο του φωσφόρου και το νερό μετατρέπονται σε φωσφορικό οξύ.
P4O10 + 6 Η2Ο4Η3ΡΟ4 (-177 kJ).
Δεύτερο παράδειγμα
Έχετε την αντίδραση καύσης του αιθανίου (μη ισορροπημένη).
Γ2H6 + Ο2 → CO2 + H2Ο
Χρησιμοποιώντας δοκιμής και λάθους για να το εξισορροπήσει, σημειώνεται ότι κανένα από τα στοιχεία έχει τον ίδιο αριθμό ατόμων στις δύο πλευρές της εξίσωσης. Έτσι, ξεκινάμε από τροχαίο άνθρακα, προσθέτοντας μια στοιχειομετρική συντελεστή ως δύο συνοδευτικά παραπροϊόντων.
Γ2H6 + Ο2 → 2CO2 + H2Ο
Ο άνθρακας έχει εξισορροπηθεί και από τις δύο πλευρές, οπότε προχωρούμε στην εξισορρόπηση του υδρογόνου προσθέτοντας τρία στο μόριο του νερού.
Γ2H6 + Ο2 → 2CO2 + 3Η2Ο
Τέλος, δεδομένου ότι υπάρχουν επτά άτομα οξυγόνου στη δεξιά πλευρά της εξίσωσης και είναι το τελευταίο στοιχείο που πρέπει ακόμα να εξισορροπηθεί, ο κλασματικός αριθμός 7/2 τοποθετείται μπροστά από το μόριο οξυγόνου (αν και γενικά προτιμούνται ολόκληροι οι συντελεστές).
Γ2H6 + 7 / 2Ο2 → 2CO2 + 3Η2Ο
Στη συνέχεια βεβαιωθείτε ότι σε κάθε πλευρά της εξίσωσης υπάρχει ο ίδιος αριθμός ατόμων άνθρακα (2), υδρογόνο (6) και οξυγόνο (7).
Τρίτο παράδειγμα
Η οξείδωση του σιδήρου από διχρωμικά ιόντα συμβαίνει σε ένα όξινο μέσο (μη ισορροπημένο και στην ιοντική του μορφή).
Πίστη2+ + Cr2Ο72- → Πίστη3+ + Cr3+
Χρησιμοποιώντας τη μέθοδο ιόντων-ηλεκτρονίων για την εξισορρόπησή του, χωρίζεται σε δύο μισές αντιδράσεις.
Οξείδωση: Πίστη2+ → Πίστη3+
Μείωση: Cr2Ο72- → Cr3+
Δεδομένου ότι τα άτομα σιδήρου είναι ήδη ισορροπημένα (1: 1), ένα ηλεκτρόνιο προστίθεται στην πλευρά των προϊόντων για να εξισορροπήσει το φορτίο.
Πίστη2+ → Πίστη3+ + ε-
Τώρα τα άτομα του Cr είναι ισορροπημένα, προσθέτοντας δύο στη δεξιά πλευρά της εξίσωσης. Στη συνέχεια, όταν η αντίδραση λαμβάνει χώρα σε όξινο μέσο, προστίθενται επτά μόρια Η.2Ή από την πλευρά των προϊόντων για την εξισορρόπηση των ατόμων οξυγόνου.
Cr2Ο72- → 2Cr3+ + 7Η2Ο
Για την εξισορρόπηση των ατόμων Η, προστίθενται δεκατέσσερα ιόντα Η+ στην πλευρά των αντιδραστηρίων και, μετά την εξίσωση του υλικού, τα φορτία ισορροπούνται με την προσθήκη έξι ηλεκτρονίων στην ίδια πλευρά.
Cr2Ο72- +14Η+ + 6ε- → 2Cr3+ + 7Η2Ο
Τέλος, προστίθενται και οι δύο μισές αντιδράσεις, αλλά επειδή υπάρχει μόνο ένα ηλεκτρόνιο στην αντίδραση οξείδωσης, όλα αυτά πρέπει να πολλαπλασιάζονται επί έξι.
6Fe2+ + Cr2Ο72- +14Η+ + 6ε- → Πίστη3+ + 2Cr3+ + 7Η2O + 6e-
Τέλος, τα ηλεκτρόνια πρέπει να εξαλειφθούν και στις δύο πλευρές της παγκόσμιας ιονικής εξίσωσης, επαληθεύοντας ότι το φορτίο και η ύλη τους είναι σωστά ισορροπημένα.
Αναφορές
- Chang, R. (2007). Χημεία (9η έκδοση). McGraw-Hill.
- Hein, Μ., Και Arena, S. (2010). Θεμελιώσεις της Ακαδημίας Χημείας, Εναλλακτικές. Ανακτήθηκε από το books.google.co.ve
- Tuli, G.D., and Soni, Ρ. L. (2016). Η Γλώσσα Χημείας ή χημικών εξισώσεων. Ανακτήθηκε από το books.google.co.ve
- Speedy Publishing (2015). Εξισώσεις και απαντήσεις χημείας (δίδυμοι οδηγοί μελέτης). Ανακτήθηκε από το books.google.co.ve


