Χαρακτηριστικά διαλυμάτων, διαφορές με διαλύτη και διαλύτη, Παραδείγματα
Το διαλυμένη ουσία, σε μια λύση,είναι η ουσία που διαλύεται στον διαλύτη. Γενικά, η διαλελυμένη ουσία βρίσκεται σε μικρότερη αναλογία και μπορεί να είναι στερεά, υγρά ή αέρια. Αντίθετα, ο διαλύτης είναι το συστατικό του διαλύματος που είναι σε περισσότερη ποσότητα.
Για παράδειγμα, στο αλατούχο νερό, το αλάτι είναι η διαλελυμένη ύλη και το νερό είναι ο διαλύτης. Ωστόσο, δεν είναι όλες οι διαλυμένες ουσίες ή οι διαλύτες είναι υγρές.

Υπό αυτή την έννοια, υπάρχουν διάφοροι πιθανοί συνδυασμοί διαλελυμένων ουσιών και διαλυτών: αέριο σε υγρό, αέριο σε στερεό, υγρό σε υγρό, υγρό σε στερεό, στερεό σε υγρό ή στερεό σε στερεό.
Για να αναγνωρίσουμε ποια είναι η διαλυμένη ουσία σε μια λύση πρέπει να ληφθούν υπόψη δύο πτυχές. Πρώτον, η διαλυμένη ουσία είναι η ουσία που είναι μικρότερη. Επιπλέον, είναι αυτός που αλλάζει τη φυσική του κατάσταση (στερεά, υγρά ή αέρια) όταν ενσωματωθεί στη λύση.
Ευρετήριο
- 1 Λύσεις, διαλύτες και διαλυμένες ουσίες
- 2 Ορισμός της διαλυμένης ουσίας
- 3 Χαρακτηριστικά
- 3.1 Διαλυτότητα
- 3.2 Θερμοκρασία
- 3.3 Κορεσμός διαλύματος
- 3.4 Πίεση
- 3.5 Πολικότητα
- 4 Διαφορές μεταξύ διαλυμένης ουσίας και διαλύτη
- 5 Παραδείγματα διαλυτής ουσίας
- 5.1 Solutos σε αέρια κατάσταση
- 5.2 Solutos σε στερεή κατάσταση
- 5.3 Solutos σε υγρή κατάσταση
- 5.4 Solutos που μπορούν να χρησιμοποιηθούν στο σπίτι
- 6 Αναφορές
Διαλύματα, διαλύτες και διαλυμένες ουσίες
Στη χημεία είναι ομοιογενή μίγματα, τα οποία είναι εκείνα τα οποία έχουν διαιρεθεί τους σε ίσες αναλογίες διαμέσου συνιστωσών το περιεχόμενό της. Ένας από τους πιο κοινούς τύπους ομοιογενών μειγμάτων είναι διαλύματα τα οποία είναι σταθερά ομογενή μίγματα δύο ή περισσότερες ουσίες, όπου μια διαλυμένη ουσία διαλύεται σε ένα διαλύτη.
Τα διαλύματα, οι διαλύτες και οι διαλυτές ουσίες παρατηρούνται στις καθημερινές καταστάσεις και σε μια περιοχή που ποικίλλει από το βιομηχανικό στο εργαστήριο. Αυτές οι ουσίες που σχηματίζονται από μείγματα είναι αντικείμενα μελέτης λόγω των χαρακτηριστικών που παρουσιάζουν και των δυνάμεων και / ή των αξιοθέατων που συμβαίνουν μεταξύ τους..
Ορισμός της διαλυμένης ουσίας
Όπως σημειώθηκε παραπάνω, μια διαλυμένη ουσία είναι αυτή που διαλύεται σε άλλη, που ονομάζεται διαλύτης.
Συνήθως η διαλυμένη ουσία έχει μικρότερη αναλογία και μπορεί να συμβεί σε οποιαδήποτε από τις τρεις καταστάσεις της ύλης. Όταν δίνεται μια λύση μεταξύ δύο ουσιών που βρίσκονται στην ίδια φάση, η μέθοδος επιλογής σε μικρότερο ποσοστό χρησιμοποιείται για να προσδιοριστεί ποια είναι η διαλυμένη ουσία και ποια είναι η ποσότητα του διαλύτη.
Η ικανότητα διάλυσης της διαλυμένης ουσίας θα διέπεται από τη διαλυτότητα. Η θερμοκρασία του διαλύτη είναι επίσης ένας καθοριστικός παράγοντας όταν γνωρίζοντας την πιθανότητα σχηματισμού ή μη ενός διαλύματος δεδομένου ότι η υψηλότερη θερμοκρασία του διαλύτη, τόσο μεγαλύτερη είναι η ποσότητα διαλυτής ουσίας που μπορεί να διαλυθεί σε αυτό.
Υπάρχουν ουσίες που ονομάζονται επιφανειοδραστικές ουσίες που καθίστανται λιγότερο διαλυτές σε υψηλότερες θερμοκρασίες, αλλά αποτελούν εξαιρέσεις και εκπληρώνουν συγκεκριμένους ρόλους.
Η διαδικασία κατά την οποία ένας διαλύτης αλληλεπιδρά με μια διαλυμένη ουσία για να σχηματιστεί ένα διάλυμα ορίζεται ως επιδιαλύτωση, που περιλαμβάνουν σχηματισμό δεσμού και δεσμούς υδρογόνου, συν τα αξιοθέατα από δυνάμεις van der Waals.
Χαρακτηριστικά
Οι διαλυμένες ουσίες περιέχουν μια τεράστια ποικιλία χημικών ουσιών σε διαφορετικές καταστάσεις, έχουν διαφορετικές ικανότητες διάλυσης και έχουν πολλά χαρακτηριστικά που παίζουν σημαντικό ρόλο στο σχηματισμό ομοιογενών μειγμάτων. Μερικά από τα κύρια χαρακτηριστικά των διαλυμένων ουσιών είναι τα ακόλουθα:
Διαλυτότητα
Η διαλυτότητα είναι η ικανότητα μιας ένωσης να διαλύεται σε μια άλλη ουσία. Αυτή η ικανότητα έχει μια στενή σχέση με την αναμειξιμότητα, η οποία είναι η ικανότητα του υγρού να αναμιγνύεται με ένα συγκεκριμένο. Εάν δεν μπορείτε να συμμετάσχετε, είναι μη αναμειξιμότητα.
Η αναμειξιμότητα έχει ένα εύρος περισσότερο από έναν συγκεκριμένο αριθμό, έτσι μπορεί να ειπωθεί ότι μία ουσία είναι εντελώς, μερικώς ή μη αναμίξιμη σε άλλη.
Η ιδιότητα ενός διαλυτού διαλυμένης ουσίας με τη σειρά της εξαρτάται από άλλους παράγοντες που μπορεί να αυξήσουν ή να μειώσουν την δυναμικότητα αυτή από την επίδραση αυτών στην ισορροπία των διαμοριακές δυνάμεις που δημιουργούνται μεταξύ διαλυμένης ουσίας και διαλύτη.
Ακόμα λιγότερο αναμενόμενα χαρακτηριστικά, όπως το μέγεθος μιας σταγόνας διαλύματος ή η σειρά στη δομή ενός κρυστάλλου, μπορεί να επηρεάσει την ικανότητά τους να διαλύονται.
Θερμοκρασία
Η θερμοκρασία του συστήματος όπου διαλύεται η διαλελυμένη ουσία μπορεί να επηρεάσει τη διαλυτότητά της: για τα περισσότερα στερεά και υγρά, αυτά αυξάνουν την ικανότητα διάλυσης ανάλογα με τις αυξήσεις της θερμοκρασίας.
Αντίθετα, στα αέρια παρατηρείται πολύπλοκη συμπεριφορά που παρουσιάζεται ως χαμηλότερη διαλυτότητα στο νερό σε υψηλότερες θερμοκρασίες, αλλά μεγαλύτερη σε οργανικούς διαλύτες.
Κορεσμός διαλύματος
Ονομάζεται κορεσμός διαλύματος στο βαθμό στον οποίο μια λύση έχει διαλύσει τη διαλυμένη ουσία, που ονομάζεται κορεσμένο διάλυμα ως εκείνο που έχει διαλυθεί όσο το δυνατόν περισσότερη διαλυμένη ουσία. Από αυτό το σημείο, η προστιθέμενη διαλυμένη ουσία θα καθιζάνει ως περίσσεια στον πυθμένα του χρησιμοποιημένου δοχείου. πριν από αυτό, η λύση ονομάζεται ακόρεστη.
Είναι δυνατόν να περάσει το σημείο κορεσμού και να συνεχιστεί η διάλυση της διαλυμένης ουσίας, αλλά αυτό απαιτεί αύξηση της θερμοκρασίας. Ένα διάλυμα που περιέχει μια περίσσεια διαλελυμένης ουσίας και το οποίο έχει θερμανθεί ονομάζεται υπερκορεσμένο διάλυμα.
Πίεση
αλλαγές πίεσης δεν επηρεάζουν συνήθως τη διαλυτότητα των στερεών και υγρών, εκτός από ορισμένες εξαιρετικές περιπτώσεις (συσσώρευση θειικού ασβεστίου σε αγωγούς πετρελαίου), αλλά αέριο είναι ένας καθοριστικός παράγοντας της ικανότητάς της να διαλύει.
Στην πραγματικότητα, η διαλυτότητα ενός αερίου σε ένα διαλύτη είναι ευθέως ανάλογη με τη μερική πίεση αυτού του αερίου στον εν λόγω διαλύτη.
Πολικότητα
Η πολικότητα μιας διαλυμένης ουσίας είναι κρίσιμη όταν μετρά την ικανότητα διάλυσης της. μια διαλελυμένη ουσία θα διαλύεται καλύτερα σε έναν διαλύτη με χημική δομή παρόμοια με αυτήν που έχει.
Για παράδειγμα, πολύ πολικές ή υδρόφιλες ουσίες θα έχουν μεγαλύτερη διαλυτότητα σε πολικούς πολικούς διαλύτες, ενώ θα είναι πρακτικά αδιάλυτες σε μη πολικές ουσίες..
Ομοίως, διαμοριακές δυνάμεις διαδραματίζουν σημαντικό ρόλο στην επιδιαλύτωσης και την ευκολία με την οποία ένας διαλύτης μπορεί να διαλύσει ένα διαλυμένης ουσίας: ένα μεγαλύτερες δυνάμεις διπόλου-διπόλου, δεσμών υδρογόνου και άλλα ομόλογα, τόσο μεγαλύτερη είναι η ικανότητα του διαλύτη για να διαλυθεί η διαλύουν και σχηματίζουν μια λύση.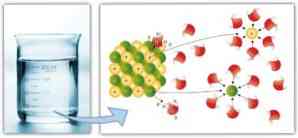
Διαφορές μεταξύ διαλελυμένης ουσίας και διαλύτη
- Η διαλυμένη ουσία είναι η ουσία που διαλύεται. ο διαλύτης είναι το μέσο για τη διάλυση της (ων) ουσίας.
- Η διαλελυμένη ουσία μπορεί να είναι σε στερεή, υγρή ή αέρια φάση. ο διαλύτης είναι συνήθως στην υγρή φάση, αλλά υπάρχει και σε στερεά και αέρια κατάσταση.
- Η διαλυτότητα της διαλυτής ουσίας εξαρτάται περισσότερο από ιδιότητες όπως η επιφάνεια. Η χωρητικότητα του διαλύτη εξαρτάται από την πολικότητα, τη θερμοκρασία και την πίεση, μεταξύ άλλων παραγόντων.
- Η διαλελυμένη ουσία είναι συνήθως το επιθυμητό συστατικό που πρέπει να εξαχθεί σε βιομηχανικές διεργασίες. Ο διαλύτης συνήθως δεν είναι το επιθυμητό συστατικό και απορρίπτεται σε βιομηχανικές διεργασίες.
Παραδείγματα διαλυτής ουσίας
- Η ζάχαρη είναι ένα παράδειγμα διαλυμένης ουσίας στερεάς φάσης, που συνήθως χρησιμοποιείται για να γλυκάνει το νερό.
- Το εξάνιο μπορεί να βρεθεί σε παραφινικό κηρό, που χρησιμεύει ως υγρή διαλυτή ουσία που κάνει αυτό το στερεό πιο εύπλαστο.
- Το διοξείδιο του άνθρακα είναι ένα αέριο που προστίθεται στα ποτά για να τους δώσει αναβρασμό.
Σόλουτα σε αέρια κατάσταση
Διοξείδιο του άνθρακα στο νερό (αναψυκτικά)
Το ανθρακικό νερό είναι το νερό που περιέχει διοξείδιο του άνθρακα και παράγεται μέσω διοχέτευσης διοξειδίου του άνθρακα υπό πίεση μέσω νερού.
Τα ανθρακούχα μεταλλικά νερά απαντώνται φυσικά για μεγάλο χρονικό διάστημα. Αυτά τα αναβράζοντα ύδατα υπάρχουν λόγω της περίσσειας του διοξειδίου του άνθρακα σε έναν υδροφορέα που έχει διαλυθεί υπό πίεση.
Ένα από τα πιο γνωστά παραδείγματα διαλελυμένων ουσιών είναι εμπορικά αναψυκτικά, τα οποία συνδυάζονται με ένα σιρόπι.
Η παρουσία διοξειδίου του άνθρακα κάνει τα νερά και τα αναψυκτικά πιο ορεκτικά και οπτικά ελκυστικά.
Οξυγόνο και άλλα αέρια σε άζωτο (αέρας)
Ο αέρας στην ατμόσφαιρα αποτελείται από μόρια διαφορετικών αερίων. Βασικά αποτελείται από 78% άζωτο και περίπου 21% οξυγόνο (διαλυμένη ουσία). Επιπλέον, περιέχει σχεδόν 1% αργού και άλλων μορίων, αλλά σε πολύ μικρές ποσότητες.
Προπάνιο σε βουτάνιο (φυσικό αέριο)
Ο συνδυασμός αυτός, γνωστός και ως υγροποιημένο αέριο πετρελαίου (LPG), άρχισε να χρησιμοποιείται από το 1860 ως πηγή καυσίμων για οικιακή χρήση..
Έκτοτε έχει επεκτείνει την παραγωγή και την κατανάλωσή του για οικιακή και βιομηχανική χρήση. Επειδή και τα δύο αέρια είναι εξαιρετικά άοσμο και επικίνδυνα, προστίθεται μια ουσία που ονομάζεται μερκαπτάνη, η οποία καθιστά κάθε διαρροή αισθητή..
Σόλτες σε στερεά κατάσταση
Χαλκός ψευδάργυρος (ορείχαλκος)
Το εμπορικό κράμα γνωστό ως ορείχαλκο σχηματίζεται από ψευδάργυρο (από 5 έως 40%) διαλυμένο σε χαλκό. Ο ψευδάργυρος βοηθά στην αύξηση της αντοχής εφελκυσμού Άλλα στοιχεία όπως κασσίτερος, σίδηρος, αλουμίνιο, νικέλιο και πυρίτιο μπορούν να προστεθούν σε αυτό το κράμα.
Ιώδιο σε αλκοόλη (βάμμα ιωδίου)
Ένα άλλο παράδειγμα γνωστής διαλυτής ουσίας είναι το βάμμα ιωδίου. Το διάλυμα αυτό περιέχει ιώδιο σε αιθυλική αλκοόλη (από 44 έως 50%). Το βάμμα ιωδίου χρησιμοποιείται ως αντισηπτικό.
Αλάτι σε νερό (θαλασσινό νερό)
Το θαλασσινό νερό καλύπτει περισσότερο από το 70% της επιφάνειας της Γης. Πρόκειται για ένα πολύπλοκο μίγμα 96,5% νερό, 2,5% άλατα και μικρότερες ποσότητες άλλων ουσιών. Αυτό περιλαμβάνει ανόργανα και διαλυμένα οργανικά υλικά, σωματίδια και μερικά ατμοσφαιρικά αέρια.
Solutos σε υγρή κατάσταση
Αλκοόλ στο νερό (αλκοολούχα ποτά)
Η αιθανόλη ή η αιθυλική αλκοόλη (διαλελυμένη ουσία) από τη ζύμωση ζάχαρης αναμιγνύεται με νερό σε σταθερές αναλογίες για την παραγωγή αλκοολούχων ποτών.
Αυτή η ένωση χωνεύεται εύκολα από το σώμα, αλλά η υπερβολική κατανάλωση μπορεί να προκαλέσει σοβαρή βλάβη στην υγεία.
Νερό στον αέρα (υγρασία στον αέρα)
Το νερό στον αέρα είναι κοινώς γνωστό ως ομίχλη. Αυτό προκαλείται από μικρές σταγόνες νερού αιωρούμενες στον αέρα και οφείλεται ουσιαστικά στην ψύξη της γης κατά τη διάρκεια της νύχτας.
Με αυτόν τον τρόπο, αυτή η ψύξη προκαλεί στον περιβάλλοντα αέρα να χαμηλώσει τη θερμοκρασία του. Στη συνέχεια, το φαινόμενο συμβαίνει όταν το συμπυκνωμένο νερό διατηρείται σε αυτό.
Οξικό οξύ σε νερό (ξύδι)
Το ξίδι είναι ένα υγρό με έντονη γεύση που χρησιμοποιείται για να προσθέσει γεύση ή να διατηρήσει τα τρόφιμα. Παρασκευάζεται με διάλυμα οξικού οξέος που αναμιγνύεται με νερό.
Η συγκέντρωση του οξικού οξέος είναι μεταβλητή. Για παράδειγμα, το αποσταγμένο ξύδι έχει ποσοστό που κυμαίνεται από 5 έως 8%.
Υδράργυρος σε ασήμι (αμάλγαμα ή οδοντικά γεμίσματα)
Τα αμάλγαμα που χρησιμοποιούνται για οδοντικά γεμίσματα σχηματίζονται από 2% υδράργυρο με κράμα που δρα ως διαλύτης. Αυτό το κράμα περιέχει 70% ασήμι. Μπορείτε επίσης να προσθέσετε κασσίτερο, χαλκό και ψευδάργυρο.
Solutos που μπορούν να χρησιμοποιηθούν στο σπίτι
Ζάχαρη στο νερό
Η ζάχαρη είναι μια μοριακή και πολική ένωση και ως εκ τούτου έχει την ικανότητα να διαλύεται στο νερό, το οποίο είναι επίσης ένα πολικό στοιχείο.
Ο τρόπος με τον οποίο δομείται η ζάχαρη θα μεταβάλει τη διαδικασία διάλυσης. Για παράδειγμα, εάν η ζάχαρη είναι σε σβώλους, θα χρειαστεί περισσότερος χρόνος για να διαλυθεί από ό, τι αν είναι σε κόκκους.
Μερικοί ειδικοί πιστεύουν ότι το νερό με ζάχαρη είναι μια πολύ σημαντική πηγή ενέργειας για τον οργανισμό. Υπάρχουν ακόμη μελέτες που αποκαλύπτουν την αποτελεσματικότητα αυτής της λύσης σε άτομα που κάνουν σωματική δραστηριότητα.
Ζάχαρη σε αλεύρι
Είναι σύνηθες για την παρασκευή ενός κέικ να αναμειχθεί πρώτα τα στερεά συστατικά, στη συνέχεια προσθέστε τα υγρά.
Η ζάχαρη είναι μια διαλυμένη ουσία που προσκολλάται στο αλεύρι, δημιουργώντας το βασικό μείγμα για το κέικ. Εκτός από αυτά τα δύο συστατικά, άλλα προστίθενται αργότερα, όπως τα αυγά, το βούτυρο ή η βανίλια.
Αυτός ο τύπος διαλυτής ουσίας είναι στερεός και, στην περίπτωση αυτή, αναμιγνύεται με διαλύτη που είναι επίσης στερεός. Η προκύπτουσα βάση μπορεί επίσης να χρησιμοποιηθεί για τη παρασκευή γλυκών ψωμιών, μπισκότων, κέικ, κέικ σφουγγαριών, μικρών πουτίγκων και πολλών άλλων γλυκών τροφίμων.
Χυμός σκόνη στο νερό
Υπάρχει μια ευρεία γκάμα κονιοποιημένων χυμών που παρασκευάζονται διαλύοντας αυτό το στοιχείο στο νερό. Στην περίπτωση αυτή η διαλυμένη ουσία είναι η σκόνη χυμού και ο διαλύτης είναι το νερό.
Η ποσότητα του διαλύτη πρέπει να είναι μεγαλύτερη από αυτή του διαλύτη, έτσι συνήθως μια ή δύο κουταλιές της σούπας χυμού διαλύονται σε ένα ποτήρι νερό. Ακόμη, υπάρχουν κάποιες σκόνες των οποίων η συγκέντρωση είναι υψηλότερη και πρέπει να χρησιμοποιηθεί μικρότερη ποσότητα.
Υπάρχουν αντίπαλοι αυτών των χυμών, όπως υποδεικνύεται συστατικά συμπεριλαμβανομένων (ως συντηρητικά, σταθεροποιητές και γλυκαντικές ουσίες, κ.λπ.) είναι επιβλαβής για την υγεία.
Χλώριο σε νερό
Ένας τρόπος για να καθαρίσετε το νερό είναι να χρησιμοποιήσετε το χλώριο ως διαλελυμένη ουσία που διαλύεται στο νερό. Αυτό απολυμαντικό χαρακτηρίζεται ως ένα από τα πιο συχνά χρησιμοποιούνται για την αφαίρεση μικροβίων, και είναι ιδανικό για να μετατρέψει μη πόσιμο νερό σε πόσιμο ένα γρήγορο, οικονομικό και εύκολο τρόπο.
Το χλώριο ως διαλυτή ουσία αυτού του διαλύματος πρέπει να ενσωματώνεται σε νερό σε συγκέντρωση όχι μεγαλύτερη από 0,2 και 0,5 χιλιοστόγραμμα ανά λίτρο.
Η ποσότητα χλωρίου που θα χρησιμοποιηθεί θα πρέπει να είναι πολύ χαμηλή, επειδή αυτή η ουσία μπορεί να είναι εξαιρετικά τοξική όταν καταναλώνεται ή εκτίθεται σε πολλές ποσότητες.
Αυτή η μέθοδος καθαρισμού του νερού είναι γνωστή ως χλωρίωση, και μπορεί να εφαρμοστεί μέσω ενός βουνού εκδρομή ή για την αγωγή νερού οικιακής χρήσης, προκειμένου να αφαιρεθούν τα βακτήρια και τα μικρόβια που μπορεί να είναι στις σωληνώσεις, μέσω των οποίων διέρχεται το νερό.
Ζωγραφική στο νερό
Το νερό είναι ο πιο καθολικός διαλύτης που υπάρχει και είναι επίσης η βάση πάνω στην οποία μπορεί να διαλυθεί μια διαλυμένη ουσία όπως το χρώμα.
Το χρώμα διαλύεται συνήθως για διάφορους λόγους. Το πιο συνηθισμένο είναι να διευκολύνετε τον καθαρισμό των βουρτσών και άλλων εργαλείων που χρησιμοποιούνται για τη βαφή.
Υπάρχουν πολλοί τύποι ζωγραφικής. Αυτά που διαλύονται καλύτερα στο νερό είναι τα λατέξ. Εκτός του ότι επιτρέπει τον καλύτερο καθαρισμό των εργαλείων, το πλεονέκτημα της αραίωσης της βαφής στο νερό πριν αρχίσει να βάφεται είναι ότι θα εγγυηθεί καλύτερο τελείωμα στην βαμμένη επιφάνεια.
Γάλα σε σκόνη σε νερό
Το γάλα σε σκόνη είναι μια διαλυμένη ουσία που σχηματίζεται μέσω της αφυδάτωσης του γάλακτος που έχει ήδη παστεριωθεί. Σκοπός αυτής της διαδικασίας είναι να διασφαλιστεί ότι το γάλα μπορεί να αποθηκευτεί καλύτερα για μεγαλύτερο χρονικό διάστημα.
Αυτή η διαλυμένη ουσία διαλύεται στο νερό και παράγει υγρό γάλα που απορροφάται συνήθως στο πρωινό, μαζί με τον καφέ ή σε διάφορα παρασκευάσματα.
Όπως και στην περίπτωση σκόνης χυμού, η ποσότητα του αραιωμένου γάλακτος πρέπει να είναι μικρότερη από την ποσότητα νερού στην οποία θέλετε να προετοιμάσετε το διάλυμα.
Απορρυπαντικό σε νερό
Κατά το πλύσιμο ρούχων, χρησιμοποιούνται απορρυπαντικά υγρού ή σκόνης. Αυτά διαλύονται σε νερό για να σχηματίσουν ένα διάλυμα που λειτουργεί ως απολυμαντικό και καθαριστικό των υφασμάτων.
Η ποσότητα της διαλυμένης ουσίας που πρέπει να χρησιμοποιηθεί σε αυτό το διάλυμα είναι μεταβλητή, ανάλογα με τον τύπο του απορρυπαντικού, την παρουσίασή του και τα συστατικά που έχει.
Το αποτελούμενο από απορρυπαντικού και διαλύματος νερού μπορεί να είναι πολύ ρύπου όταν είναι σε επαφή με το νερό χωματερές, γι 'αυτό συνιστάται να χρησιμοποιήσει βιοδιασπώμενα απορρυπαντικά, τα οποία μπορεί να γίνει υποβαθμισμένη σε σύντομο χρονικό διάστημα και να επηρεάσουν το περιβάλλον πολύ λιγότερο.
Ζελατίνη
Η ζελατίνη είναι ένα στοιχείο που αποτελείται από τένοντες, συνδέσμους και οστά ζώων. Αυτή η ένωση μπορεί να είναι σε σκόνη ή σε φύλλα.
Και στις δύο περιπτώσεις, αυτή η διαλυμένη ουσία πρέπει να διαλύεται σε ζεστό νερό για να επιτευχθεί το τελικό αποτέλεσμα: ένα γλυκό φαγητό ιδανικό για ένα επιδόρπιο και με πολλά οφέλη για την υγεία.
Μεταξύ των πλεονεκτημάτων αυτής της ένωσης είναι ότι ευνοεί την ταχεία αποκατάσταση ιστών και είναι ένα αντιφλεγμονώδες τρόφιμο. Επιπλέον, έχει μεγάλη ποσότητα πρωτεϊνών και παίζει σημαντικό ρόλο στην οχύρωση του ανοσοποιητικού συστήματος.
Η κατανάλωση μικρής ημερήσιας ποσότητας ζελατίνης θα βοηθήσει στην αναγέννηση των αρθρώσεων και έτσι θα προκαλέσει την εμφάνιση οστεοπόρωσης.
Σοκολάτα στο γάλα
Η σοκολάτα είναι ένα στοιχείο που δημιουργείται χάρη στο μείγμα κακάου και βουτύρου κακάο. Αυτό το τρόφιμο λειτουργεί ως μια διαλυμένη ουσία όταν αναμιγνύεται με γάλα για να προετοιμάσει αυτό που είναι κοινώς γνωστό ως ζεστή σοκολάτα.
Για αυτό το παρασκεύασμα η επιθυμητή ποσότητα γάλακτος θερμαίνεται και η σοκολάτα προστίθεται, σε τεμάχια, σε σκόνη ή υγρό, αναδεύοντας συνεχώς.
Για να διαλύεται αυτή η διαλυμένη ουσία με τον καλύτερο δυνατό τρόπο και για να αποφεύγονται οι σβώλοι, είναι απαραίτητο να χτυπήσετε το μείγμα χωρίς παύση.
Κακάο σε σκόνη
Μπορείτε επίσης να παρασκευάσετε ζεστή σοκολάτα χρησιμοποιώντας σκόνη κακάου. Αυτή η διαλελυμένη ουσία σχηματίζεται μόνο από τη μάζα του κονιοποιημένου κακάου. Σε αντίθεση με τη σοκολάτα, το κακάο δεν περιλαμβάνει το βούτυρο αυτού του καρπού.
Το κακάο μπορεί να διαλυθεί τέλεια στο νερό για να δημιουργήσει ένα ποτό με αρωματισμένη σοκολάτα. Σε αυτές τις περιπτώσεις είναι απαραίτητο να γλυκάνετε το μίγμα με ζάχαρη, μέλι ή κάποια γλυκαντική ουσία. αλλιώς το αποτέλεσμα θα είναι εξαιρετικά πικρό.
Αναφορές
- Lambert, Ν. And Mohammed, Μ. (1993). Χημεία για CXC. Οξφόρδη: Heinemann.
- Steen, D.P. (2008). Διοξείδιο του άνθρακα, ενανθράκωση και τις αρχές της τεχνολογίας πλήρωσης. Στο D. Ρ. Steen, Philip και Ρ. R. Ashurst (εκδότες), ανθρακούχα αναψυκτικά: σύνθεση και παρασκευή, σελ. 112-143. Oxford: Εκδόσεις Blackwell.
- Τι είναι στον αέρα; (s / f). Κέντρο Εκπαίδευσης Επιστημών της UCAR. Ανακτήθηκε στις 17 Οκτωβρίου 2017, από το eo.ucar.edu
- Υγροποιημένο αέριο πετρελαίου. (2013, 12 Ιουλίου). Encyclopædia Britannica.
Ανακτήθηκε στις 16 Οκτωβρίου 2017, από britannica.com - Lytle, D. Α. And Schock, Μ. R. (1996). Χρόνος στασιμότητας, Σύνθεση, ΡΗ και ορθοφωσφορικά αποτελέσματα στην έκπλυση μετάλλων από ορείχαλκο. Ohio: Η.Π.Α. Οργανισμός Προστασίας Περιβάλλοντος.
- Crabwee, Τ. D.; Pelletier, S.J. and Pruett, Τ. L. (2001). Χειρουργική αντισηψία Στο S. S. Block (editor), απολύμανση, αποστείρωση και συντήρηση, σελ. 919-934. Φιλαδέλφεια: Lippincott Williams & Wilkins.
- Byrne, R. Η. Et αϊ (2017, June 07). Θαλασσινό νερό. Encyclopædia Britannica. Ανακτήθηκε στις 17 Οκτωβρίου 2017, από britannica.com
- Plutowska Β. And Wardencki, W. (2012). Αέρια χρωματογραφία-ολφατομετρία αλκοολούχων ποτών. Στο J. Piggott (editor), Alcoholic Beverages: Αισθητική Αξιολόγηση και Έρευνα Καταναλωτών, σελ. 101-122. Φιλαδέλφεια: Εκδόσεις Woodhead.
- Τι είναι η ομίχλη; (2017, 12 Ιουλίου). Met Office (Ηνωμένο Βασίλειο). metoffice.gov.uk
- Helmenstine, Α. Μ. (2016, 16 Φεβρουαρίου). Ποια είναι η χημική σύνθεση του ξιδιού; Ανακτήθηκε στις 17 Οκτωβρίου 2017, από thoughtco.com
- Phinney, D.J. and Halstead, J.H. (2017). Οδοντιατρική βοήθεια: μια ολοκληρωμένη προσέγγιση. Μασαχουσέτη: Εκμάθηση των υπηρεσιών.
- Britannica, Ε. (S.f.). Λύση-Χημεία Ανακτήθηκε από britannica.com
- Wikipedia. (s.f.). Διαλυτότητα. Ανακτήθηκε από en.wikipedia.org
- Classzone (s.f.). Διαλύει. Ανακτήθηκε από frsd.k12.nj.us
- ChemGuide. (s.f.). Κορεσμένα διαλύματα και διαλυτότητα. Ανακτήθηκε από chem.libretexts.org
- Madhusha (s.f.). Διαφορά μεταξύ διαλύτη και διαλύτη. Ανακτήθηκε από pediaa.com.


