Η αντίδραση σαπωνοποίησης και οι ουσίες που μπορούν να ληφθούν
Το σαπωνοποίηση Είναι η βασική υδρόλυση ενός εστέρα. Αυτό σημαίνει ότι ο εστέρας αντιδρά με βάση (NaOH ή KOH) μη αναστρέψιμα, παράγοντας αλκοόλη και καρβοξυλικά άλατα νατρίου ή καλίου. Η λέξη σημαίνει "κατασκευή σαπουνιών" και, στην πραγματικότητα, είναι μία από τις παλαιότερες χημικές αντιδράσεις που χρησιμοποιεί η ανθρωπότητα.
Στους Βαβυλωνιακούς χρόνους, με τη βοήθεια των στάχρων που συλλέγονται από ξύλο και φυτά και ζωικά λίπη, τελειοποίησαν την τέχνη της παρασκευής σαπουνιών. Γιατί ζωικό λίπος; Ο λόγος είναι ότι είναι πλούσιο σε τριεστέρες γλυκερόλης (τριγλυκερίδια), και η τέφρα από ξύλο είναι μια πηγή καλίου, το βασικό μέταλλο.
Διαφορετικά, η αντίδραση προχωρά σε χαμηλότερη απόδοση, αλλά αρκετή για να αντικατοπτρίζει τις επιδράσεις της στα χρώματα και σε ορισμένες επιφάνειες. Αυτή είναι η περίπτωση των ελαιογραφιών, όπου οι χρωστικές αναμειγνύονται με το έλαιο (πηγή εστέρων).
Ευρετήριο
- 1 Αντίδραση σαπωνοποίησης
- 1.1 Μηχανισμός
- 1.2 Κινητική
- 2 Ουσίες που μπορούν να ληφθούν με σαπωνοποίηση
- 2.1 Δράση διαλυτών σαπουνιών
- 3 Αναφορές
Η αντίδραση σαπωνοποίησης
Μηχανισμός
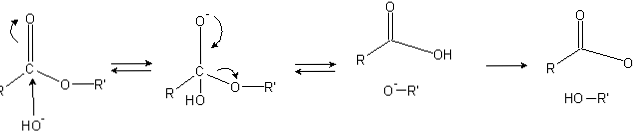
Οι εστέρες έχουν ομάδα ακυλίου (Ο = C-R), η οποία είναι ευαίσθητη σε νουκλεόφιλες προσβολές όπως ΟΗ-.
Επειδή τα άτομα του οξυγόνου "κλέβουν" την ηλεκτρονική πυκνότητα από το άτομο άνθρακα, είναι εν μέρει φορτισμένα, ακόμα περισσότερο στην περίπτωση των εστέρων.
Συνεπώς, αυτό το θετικό φορτίο προσελκύει αρνητικά είδη ικανά να τροφοδοτήσουν ηλεκτρόνια στο άτομο άνθρακα, με την πυρηνόφιλη επίθεση να συμβαίνει (την αριστερή πλευρά της εικόνας). Ως αποτέλεσμα, σχηματίζεται ένα τετραεδρικό ενδιάμεσο (το δεύτερο μόριο από αριστερά προς τα δεξιά).
Το αρνητικό φορτίο στο οξυγόνο του τετραεδρικού ενδιαμέσου είναι το προϊόν ενός ΟΗ- περιβάλλον Στη συνέχεια, αυτό το αρνητικό φορτίο απομακρύνεται από το σημείο αποχώρησης από την καρβονυλική ομάδα, "αναγκάζοντας" στη συνέχεια να σπάσει τον δεσμό C-OR '. Επίσης, αυτή η μετεγκατάσταση παράγει καρβοξυλικό οξύ RCOOH και ιόν αλκοξειδίου R'O-.
Τέλος, καθώς το μέσο αντίδρασης είναι βασικό, το αλκοξείδιο αποπρωτονιώνει ένα μόριο νερού και το καρβοξυλικό οξύ αντιδρά με άλλο ΟΗ- του μέσου, δημιουργώντας τα προϊόντα σαπωνοποίησης.
Κινητική
Η ταχύτητα της αντίδρασης σαπωνοποίησης είναι ανάλογη με τις συγκεντρώσεις των αντιδραστηρίων. Με άλλα λόγια, αυξάνοντας είτε τη συγκέντρωση του εστέρα (RCOOR ') είτε της βάσης (ΝαΟΗ), η αντίδραση θα προχωρήσει σε υψηλότερο ρυθμό.
Αυτό μεταφράζεται επίσης ως εξής: ο ρυθμός σαπωνοποίησης είναι πρώτης τάξης σε σχέση με τον εστέρα και πρώτης τάξης σε σχέση με τη βάση. Τα παραπάνω μπορούν να εκφραστούν με την ακόλουθη μαθηματική εξίσωση:
Ταχύτητα = k [RCOOR '] [ΝαΟΗ]
Όπου k είναι ο σταθερός συντελεστής ή ο συντελεστής ταχύτητας, ο οποίος ποικίλλει ως συνάρτηση της θερμοκρασίας ή της πίεσης. δηλαδή, όσο υψηλότερη είναι η θερμότητα, τόσο μεγαλύτερη είναι η ταχύτητα σαπωνοποίησης. Για το λόγο αυτό το μέσο υπόκειται σε βρασμό.
Καθώς και τα δύο αντιδραστήρια είναι κινητικής πρώτης τάξης, η συνολική αντίδραση είναι δεύτερης τάξης.
Στον μηχανισμό αντίδρασης της σαπωνοποίησης, ο σχηματισμός του τετραεδρικού ενδιαμέσου απαιτεί την πυρηνόφιλη προσβολή, η οποία περιλαμβάνει τόσο τον εστέρα όσο και τη βάση.
Επομένως, η κινητική δεύτερης τάξης αντικατοπτρίζεται σε αυτό το γεγονός, επειδή παρεμβαίνει στο (αργό) καθοριστικό βήμα της αντίδρασης.
Ουσίες που μπορούν να ληφθούν με σαπωνοποίηση

Τα κύρια προϊόντα της σαπωνοποίησης είναι αλκοόλες και άλατα καρβοξυλικών οξέων. Σε ένα όξινο μέσο λαμβάνεται η αντίστοιχη RCOOH, που λαμβάνεται με την σαπωνοποίηση των λιπών και ελαίων, τα οποία είναι γνωστά ως λιπαρά οξέα..
Με αυτόν τον τρόπο, τα σαπούνια αποτελούνται από άλατα των λιπαρών οξέων που προκύπτουν από την σαπωνοποίηση. Πηγαίνετε έξω με τι κατιόντα; Μπορούν να είναι Na+, Κ+, Mg2+, Πίστη3+, κ.λπ..
Αυτά τα άλατα είναι διαλυτά στο νερό, αλλά κατακρημνίζονται με τη δράση του NaCl που προστίθεται στο μείγμα, το οποίο αφυδατώνει το σαπούνι και το διαχωρίζει από την υδατική φάση. Η αντίδραση σαπωνοποίησης για ένα τριγλυκερίδιο είναι ως εξής:
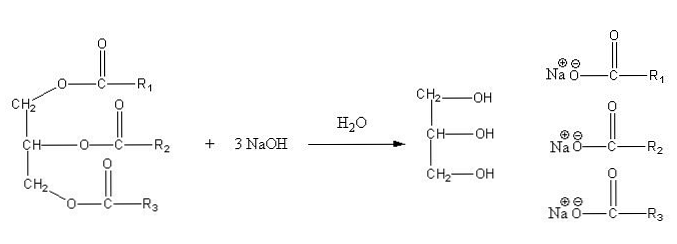
Η γλυκερίνη είναι το αλκοολικό "Ε", και σαπούνι είναι όλα τα άλατα των προκυπτόντων λιπαρών οξέων. Εδώ, κάθε πλευρική αλυσίδα -R έχει διαφορετικά μήκη και βαθμό ακορεστότητας. Κατά συνέπεια, αυτές οι αλυσίδες κάνουν τη διαφορά μεταξύ λιπών και φυτικών ελαίων.
Το κλειδί για την κατασκευή σαπουνιών έγκειται τότε στην επιλογή των καλύτερων λιπών και ελαίων, ή πιο συγκεκριμένα, στην επιλογή διαφορετικών πηγών τριγλυκεριδίων.
Αυτή η λευκή σαπουνιστική μάζα μπορεί να περιέχει βαφές και άλλες οργανικές ενώσεις στη δομή της, δίνοντάς της ευχάριστα αρώματα και φωτεινά χρώματα. Από εδώ, το φάσμα των δυνατοτήτων εξημερώνεται από την τέχνη και τον επαγγελματισμό σε αυτό το εμπόριο.
Ωστόσο, η αντίδραση σαπωνοποίησης είναι επίσης μια συνθετική οδός καρβοξυλικών οξέων και αλκοολών που δεν έχουν απαραίτητα να κάνουν με γλυκερίνη ή σαπούνια.
Για παράδειγμα, βασική υδρόλυση οποιουδήποτε εστέρα, όπως απλό οξικό αιθύλιο, θα παράγει οξικό οξύ και αιθανόλη.
Δράση διαλυτών σαπουνιών

Τα άλατα των λιπαρών οξέων είναι διαλυτά στο νερό, αλλά όχι με τον ίδιο τρόπο όπως τα διαλύματα διαλύονται. δηλαδή, περιβάλλεται από μια υδατική σφαίρα. Στην περίπτωση των σαπουνιών, οι πλευρικές τους αλυσίδες -R εμποδίζουν τους θεωρητικά να διαλύονται στο νερό.
Επομένως, για να εξουδετερώσουν αυτήν την ενεργά δυσάρεστη θέση, είναι προσανατολισμένες κατά τέτοιο τρόπο ώστε αυτές οι αλυσίδες να έρχονται σε επαφή σχηματίζοντας έναν απολιθικό οργανικό πυρήνα, ενώ οι πολικές κεφαλές, το άκρο (-COO)- Na+), αλληλεπιδρούν με τα μόρια του νερού και δημιουργούν ένα "πολικό κέλυφος".
Τα παραπάνω απεικονίζονται στην παραπάνω εικόνα, όπου παρουσιάζεται αυτός ο τύπος δομής γνωστός ως μικκύλ.
Οι "μαύρες ουρές" αντιστοιχούν στις υδρόφοβες αλυσίδες, που εμπλέκονται σε έναν οργανικό πυρήνα που προστατεύεται από τις γκρίζες σφαίρες. Αυτές οι γκρίζες σφαίρες αποτελούν την πολική ασπίδα, τα κεφάλια -COO- Na+.
Στη συνέχεια, τα μικκύλια είναι συστάδες (συστάδες) των αλάτων των λιπαρών οξέων. Μέσα σε αυτά μπορούν να περικλείσουν λίπος, το οποίο είναι αδιάλυτο στο νερό λόγω του απολιθικού χαρακτήρα του.
Πώς το κάνουν; Τόσο το λίπος όσο και οι αλυσίδες -R είναι υδρόφοβες, και οι δύο έχουν μεγάλη συγγένεια μεταξύ τους.
Όταν τα μικκύλια περικλείουν τα λίπη, το νερό αλληλεπιδρά με το πολικό κέλυφος, επιτρέποντας τη διαλυτότητα του σαπουνιού. Παρομοίως, τα μικύλλια φορτώνονται αρνητικά, προκαλώντας απώλειες μεταξύ τους και, συνεπώς, δημιουργώντας τη διασπορά του λίπους.
Αναφορές
- Anne Marie Helmenstine, Ph.D. (3 Οκτωβρίου 2017). Ορισμός και αντίδραση σαπωνοποίησης. Ανακτήθηκε στις 24 Απριλίου 2018, από: thoughtco.com
- Francis A. Carey. Οργανική Χημεία Καρβοξυλικά οξέα. (έκτη έκδοση, σελ. 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig Β. Fryhle. Οργανική Χημεία. Lipids (10η έκδοση., Σελίδα 1056-1058). Wiley Plus.
- Wikipedia. (2018). Σαπωνοποίηση. Ανακτήθηκε στις 24 Απριλίου 2018, από: en.wikipedia.org
- Boyd C. (27 Φεβρουαρίου 2015). Κατανοήστε τη χημεία και την ιστορία του σαπουνιού. Ανακτήθηκε στις 24 Απριλίου 2018, από: chemservice.com
- Λούκα Λαγκί (27 Μαρτίου 2007). Σαπωνοποίηση. Ανακτήθηκε στις 24 Απριλίου 2018 από: commons.wikimedia.org
- Amanda Crochet (12 Μαΐου 2015). Micelle (κλίμακα του γκρι). Ανακτήθηκε στις 24 Απριλίου 2018 από: commons.wikimedia.org


