Τύπος υδριδίου μαγνησίου, χημική δομή και ιδιότητες
Το υδρίδιο μαγνησίου (MgH2 του μοριακού τύπου), είναι μια χημική ένωση με περιεκτικότητα σε βάρος υδρογόνου 7,66% και βρέθηκε στη φύση ως ένα λευκό κρυσταλλικό στερεό. Χρησιμοποιείται κυρίως για την παρασκευή άλλων χημικών ουσιών, αν και έχει επίσης μελετηθεί ως πιθανό μέσο αποθήκευσης υδρογόνου.
Ανήκει στην οικογένεια αλατούχων (ή ιοντικών) υδριδίων, αυτά που ορίζονται από ένα αρνητικά φορτισμένο ιόν Η. Αυτά τα υδρίδια θεωρούνται εκείνα που σχηματίζονται από μέταλλα αλκαλίων και μέταλλα αλκαλικών γαιών, αλλά στην περίπτωση του μαγνησίου (και βηρύλλιο) έχουν ομοιοπολικούς δεσμούς, ιοντική επιπλέον εκείνων που χαρακτηρίζουν αυτή την οικογένεια υδρίδια.
Ευρετήριο
- 1 Παρασκευή και τύπος
- 2 Χημική δομή
- 3 Φυσικές και χημικές ιδιότητες
- 3.1 Φυσική
- 3.2 Χημικές ουσίες
- 4 Χρήσεις
- 4.1 Αποθήκευση υδρογόνου
- 4.2 Αντιδράσεις υδρογόνωσης και αφυδρογόνωσης
- 4.3 Λάμψη
- 4.4 Κύτταρα καυσίμου
- 4.5 Μεταφορές και ενέργεια
- 4.6 Αλκυλίωση
- 5 Κίνδυνοι
- 5.1 Αντίδραση με νερό
- 5.2 Είναι πυροφορικό
- 6 Αναφορές
Προετοιμασία και τύπος
Το υδρίδιο του μαγνησίου σχηματίζεται μέσω της άμεσης υδρογόνωσης του μετάλλου μαγνησίου (Mg) υπό συνθήκες υψηλής πίεσης και θερμοκρασίας (200 ατμόσφαιρες, 500 ° C) με καταλύτη Mgl2. Η αντίδρασή του είναι ισοδύναμη με:
Mg + Η2→ MgH2
Η παραγωγή MgH έχει επίσης διερευνηθεί2 σε χαμηλότερες θερμοκρασίες με τη χρήση νανοκρυσταλλικού μαγνησίου που παράγεται σε μύλους σφαιρών.
Υπάρχουν επίσης και άλλες μέθοδοι παρασκευής, αλλά αντιπροσωπεύουν περισσότερο πολύπλοκες χημικές αντιδράσεις (υδρογόνωση του μαγνησίου-ανθρακενίου diethylmagnesium την αντίδραση μεταξύ υδρίδιο λιθίου αργιλίου, και ως προϊόν ενός συμπλόκου MGH2).
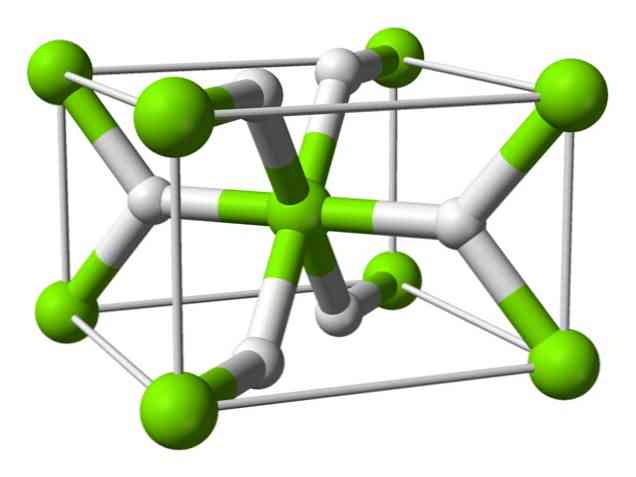
Χημική δομή
Αυτό το άτομο έχει μια δομή ρουτιλίου σε θερμοκρασία δωματίου, με τετραγωνική κρυσταλλική δομή. Έχει τουλάχιστον τέσσερις διαφορετικές μορφές υπό συνθήκες υψηλής πίεσης και έχει παρατηρηθεί επίσης μία μη στοιχειομετρική δομή με ανεπάρκειες υδρογόνου. η τελευταία εμφανίζεται μόνο σε πολύ μικρές ποσότητες σωματιδίων όταν σχηματίζονται.
Όπως αναφέρθηκε παραπάνω, οι δεσμοί που υπάρχουν στη δομή του ρουτιλίου έχουν εν μέρει ομοιοπολικές ιδιότητες αντί να είναι καθαρά ιοντικές, όπως και άλλα υδρίδια αλατόνερου.
Αυτό προκαλεί το άτομο μαγνησίου να έχει σφαιρικό σχήμα, πλήρως ιονισμένο, αλλά το ιόν του υδριδίου του έχει επιμήκη δομή.
Φυσικές και χημικές ιδιότητες
Φυσική
- Εμφάνιση: Λευκοί κρύσταλλοι.
- Μοριακή μάζα: 26,3209 g / mol
- Πυκνότητα: 1,45 g / cm3
- Σημείο τήξης: 285 ° C αποσυντίθεται
- Διαλυτότητα: Στο νερό αποσυντίθεται.
Αυτή η χημική ένωση έχει μοριακό βάρος 26,321 g / mol, πυκνότητα 1,45 g / cm3 και έχει σημείο τήξης 327 ° C.
Χημικές ουσίες
- Πρόδρομος για την παρασκευή άλλων χημικών ουσιών.
- Αποθήκευση υδρογόνου, ως πιθανή πηγή ενέργειας.
- Αναγωγικός παράγοντας στην οργανική σύνθεση.
Είναι σημαντικό να υποδείξετε ότι αυτή η ένωση δεν μπορεί να φθάσει σε υγρή κατάσταση και όταν μεταφέρεται ή σημείο τήξης ή εισάγεται σε νερό, αποσυντίθεται. Αυτό το υδρίδιο είναι αδιάλυτο σε αιθέρα.
Είναι μια πολύ αντιδραστική και πολύ εύφλεκτη ουσία και είναι επίσης πυροφορικός, δηλαδή μπορεί να ανάψει αυθόρμητα στον αέρα. Αυτές οι τρεις συνθήκες αντιπροσωπεύουν κινδύνους ασφαλείας που θα αναφερθούν στην τελευταία ενότητα αυτού του άρθρου.
Χρησιμοποιεί
Αποθήκευση υδρογόνου
Το υδρίδιο του μαγνησίου αντιδρά εύκολα με νερό για να σχηματίσει αέριο υδρογόνο, μέσω της ακόλουθης χημικής αντίδρασης:
MgH2+2Η2O → 2H2+Mg (ΟΗ)2
Επιπλέον, αυτή η ουσία αποσυντίθεται σε θερμοκρασία 287 ° C και πίεση 1 bar, ως εξής:
MgH2→ Mg + Η2
Ως εκ τούτου, έχει προταθεί η χρήση υδριδίου μαγνησίου ως μέσου αποθήκευσης υδρογόνου για τη χρήση και τη μεταφορά του.
υδρογόνωση και αφυδρογόνωση μιας ποσότητας μεταλλικού μαγνησίου ως ένας τρόπος για να μεταφέρει ποσότητες προκύπτει αερίου υδρογόνου, εξασφαλίζοντας καμία διαρροή αυτών σε μεταφορά και αντιπροσωπεύουν μια ασφαλέστερη και πιο βολικό τρόπο από ό, τι με τη χρήση σκαφών υψηλής πίεσης.
Αντιδράσεις υδρογόνωσης και αφυδρογόνωσης
Αν και η θερμοκρασία αποσύνθεσης του υδριδίου μαγνησίου αντιπροσωπεύει έναν περιοριστικό παράγοντα για τη χρήση του, έχουν προταθεί μέθοδοι για τη βελτίωση της κινητικής των αντιδράσεων υδρογόνωσης και αφυδρογόνωσης. Ένα από αυτά είναι με τη μείωση του μεγέθους του σωματιδίου μαγνησίου με τη χρήση μύλων σφαιρών.
Λάσπη
Επιπλέον, έχει προταθεί ένα σύστημα που παράγει ένα υδρίδιο μαγνησίου υπό τη μορφή λάσπης (πιο εύχρηστος και ασφαλής από ότι σε σκόνη ή άλλα στερεά σωματίδια), που θα αντιδράσει με νερό για να ληφθεί το επιθυμητό υδρογόνο.
Εκτιμάται ότι το προαναφερθέν ιλύς θα αποτελείται από μια λεπτή άλεση υδρίδιο, προστατεύεται με ένα προστατευτικό στρώμα των ελαίων και εναιωρήθηκε σε παράγοντες διασποράς για να εξασφαλιστεί ότι διατηρεί τη συνοχή χωρίς απώλεια υλικού, και το οποίο δεν απορροφά υγρασία.
Αυτή η λάσπη έχει το πλεονέκτημα ότι μπορεί να αντληθεί μέσω οποιουδήποτε κοινού πετρελαίου, βενζίνης ή αντλίας νερού, κάνοντας αυτή την οικονομική πρόταση καθώς και αποτελεσματική.
Κύτταρα καυσίμου
Το υδρίδιο του μαγνησίου μπορεί να εφαρμοστεί στην παραγωγή προηγμένων κυψελών καυσίμου, αλλά και στη δημιουργία μπαταριών και αποθήκευσης ενέργειας.
Μεταφορές και ενέργεια
Τις τελευταίες δεκαετίες έχει εξεταστεί η χρήση υδρογόνου ως πηγής ενέργειας. Η εμφύτευση του υδρογόνου ως καυσίμου απαιτεί την εύρεση ασφαλών και αναστρέψιμων συστημάτων αποθήκευσης και με υψηλή ογκομετρική χωρητικότητα (ποσότητα υδρογόνου ανά μονάδα όγκου) και βαρυμετρική (ποσότητα υδρογόνου ανά μονάδα μάζας).
Αλκυλίωση
Αλκυλίωση (προσθέστε ομάδες CH αλκυλίου3R) οργανικών ενώσεων σε βασικό μέσο, όπου υπάρχει παρουσία ομάδων -ΟΗ σε χαμηλές συγκεντρώσεις και θερμοκρασίες υψηλότερες από το σημείο τήξης του υδριδίου.
Στην περίπτωση αυτή τα υδρογόνα που υπάρχουν στο υδρίδιο του μαγνησίου (MgH2), ενώνονται με τις ομάδες -ΟΗ που σχηματίζουν νερό. Το ελεύθερο μαγνήσιο μπορεί να δεχθεί το αλογόνο που συχνά συνοδεύει το μόριο αλκυλίου που προορίζεται να συνδεθεί με την υδρογονανθρακική αλυσίδα.
Κίνδυνοι
Αντίδραση με νερό
Όπως αναφέρθηκε ήδη, το υδρίδιο του μαγνησίου είναι μια ουσία που αντιδρά πολύ εύκολα και βίαια με νερό, παρουσιάζοντας την ικανότητα να εκραγεί σε υψηλότερες συγκεντρώσεις.
Αυτό συμβαίνει επειδή η εξώθερμη αντίδρασή του παράγει αρκετή θερμότητα για να αναφλέξει το αέριο υδρογόνο που απελευθερώνεται στην αντίδραση αποσύνθεσης, οδηγώντας σε μάλλον επικίνδυνη αλυσιδωτή αντίδραση..
Είναι πυροφορικό
Το υδρίδιο του μαγνησίου είναι επίσης πυροφορικό, πράγμα που σημαίνει ότι μπορεί να αναφλεγεί αυθόρμητα με την παρουσία υγρού αέρα και σχηματίζει οξείδιο του μαγνησίου και νερό.
Η εισπνοή του δεν συνιστάται σε στερεά κατάσταση ή σε επαφή με τους ατμούς του: η ουσία στην φυσική της κατάσταση και τα προϊόντα της αποσύνθεσης μπορεί να προκαλέσουν σοβαρούς τραυματισμούς ή ακόμη και θάνατο.
Μπορεί να παράγει διαβρωτικά διαλύματα σε επαφή με το νερό και μόλυνση του. Η επαφή με το δέρμα και τα μάτια δεν συνιστάται και δημιουργεί επίσης ερεθισμό στις βλεννογόνες μεμβράνες.
Δεν έχει αποδειχθεί ότι υδρίδιο του μαγνησίου μπορεί να δημιουργήσει χρόνιες επιδράσεις στην υγεία, όπως ο καρκίνος, αναπαραγωγικά ελαττώματα ή άλλης σωματικής ή διανοητικής συνέπειες, αλλά η χρήση του προστατευτικού εξοπλισμού συνιστάται κατά το χειρισμό (ιδιαίτερα αναπνευστήρες ή μάσκες, για τους λεπτή σκόνη χαρακτήρα).
Κατά την εργασία με αυτή την ουσία, η υγρασία του αέρα πρέπει να διατηρείται σε χαμηλά επίπεδα, να σβήνουν όλες τις πηγές ανάφλεξης και να μεταφέρονται σε τύμπανα ή άλλα εμπορευματοκιβώτια..
Θα πρέπει πάντα να αποφεύγετε να εργάζεστε με μεγάλες συγκεντρώσεις αυτής της ουσίας όταν μπορεί να αποφευχθεί, καθώς η πιθανότητα μιας έκρηξης μειώνεται σημαντικά.
Εάν εμφανιστεί διαρροή υδριδίου μαγνησίου, η περιοχή εργασίας πρέπει να απομονωθεί και η σκόνη να συλλεχθεί με ηλεκτρική σκούπα. Ποτέ δεν πρέπει να χρησιμοποιήσετε τη μέθοδο ξηρού σκουπίσματος. αυξάνει τις πιθανότητες αντίδρασης με υδρίδιο.
Αναφορές
- Zumdahl S.S (1998). Εγκυκλοπαίδεια Britannica. Λήψη από britannica.com.
- PubChem. (2005). PubChem Open Chemistry Database. Λαμβάνεται από το pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Πράσινο Συνέδριο Αυτοκινήτου. Λήψη από το greencarcongress.com.
- Chemicals, C. (n.d.). Cameo Chemicals. Λαμβάνεται από cameochemicals.noaa.gov.
- Services, Ν. J. (1987). New Jersey Υπουργείο Υγείας και Ανώτερων Υπηρεσιών. Λήψη από nj.gov.


