Περιεκτικότητα σε υδρίδιο ασβεστίου (CaH2), αντιδραστικότητα και χρήσεις
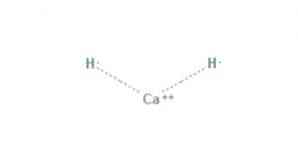
Το υδρίδιο του ασβεστίου είναι μια χημική ένωση του τύπου CaH2, η οποία την καθιστά υδρίδιο αλκαλικής γαίας. Αυτή η χημική ένωση έχει δύο ιονικούς δεσμούς μεταξύ του ασβεστίου και των δύο ιόντων υδριδίου, όπως φαίνεται στο Σχήμα 1.
Είναι ένα υδρίδιο αλατόνερου, που σημαίνει ότι η δομή του είναι παρόμοια με το αλάτι. Η κρυσταλλική δομή του είναι ίδια με αυτή του χλωριούχου μολύβδου (Cotunnite mineral) όπως φαίνεται στο σχήμα 2.

Όλα τα αλκαλικά και τα αλκαλικά μέταλλα σχηματίζουν άλατα υδριδίου. Στη χημεία, ένα υδρίδιο είναι το ανιόν υδρογόνου, Η- ή, συνηθέστερα, μια ένωση στην οποία ένα ή περισσότερα κέντρα υδρογόνου έχουν πυρηνόφιλες, αναγωγικές ή βασικές ιδιότητες.
Σε ενώσεις που θεωρούνται υδρίδια, το άτομο υδρογόνου συνδέεται με ένα περισσότερο ηλεκτροθετικό στοιχείο ή ομάδα.
Μπορεί να παραχθεί με αντίδραση ασβεστίου και υδρογόνου σε θερμοκρασία μεταξύ 300 και 400 βαθμών Κελσίου. Ένας άλλος τρόπος παρασκευής υδριδίου ασβεστίου είναι η θέρμανση του χλωριούχου ασβεστίου μαζί με το υδρογόνο και το μεταλλικό νάτριο Η αντίδραση συμβαίνει ως εξής:
CaCl2 + Η2 + 2Na → CaH2 + 2NaCl
Σε αυτή την αντίδραση το ασβέστιο (Ca) και το υδρογόνο (H) δημιουργούν ένα μόριο υδριδίου του ασβεστίου ενώ τα άτομα νατρίου μαζί με το χλώριο δημιουργούν μόρια χλωριούχου νατρίου (NaCl).
Το υδρίδιο του ασβεστίου μπορεί επίσης να παραχθεί με μείωση του οξειδίου του ασβεστίου (CaO) με μαγνήσιο (Mg). Η αντίδραση διεξάγεται παρουσία υδρογόνου. Αυτή η αντίδραση παράγει επίσης οξείδιο του μαγνησίου (MgO). Παρακάτω είναι ο τύπος αυτής της χημικής αντίδρασης:
CaO + Mg + Η2 → CaH2 + MgO
Ευρετήριο
- 1 Φυσικές και χημικές ιδιότητες του υδριδίου του ασβεστίου
- 2 Δραστικότητα και κίνδυνοι
- 3 Χειρισμός και αποθήκευση
- 4 Χρήσεις και εφαρμογές
- 4.1 Αποξηραντικό μέσο
- 4.2 Παραγωγή υδρογόνου
- 4.3 Αναγωγικός παράγοντας
- 5 Μειονέκτημα στη χρήση υδριδίου του ασβεστίου
- 6 Αναφορές
Φυσικές και χημικές ιδιότητες του υδριδίου του ασβεστίου
Το υδρίδιο του ασβεστίου είναι ένα σύνολο κρυστάλλων με λευκή ορθορομβική δομή όταν είναι καθαρό. Γενικά, είναι σπάνιο να το βρούμε σε αυτή τη μορφή, ώστε να έχει συνήθως γκριζωπό χρώμα. Χωρίς χαρακτηριστική οσμή. Η εμφάνισή του φαίνεται στο σχήμα 3 (Royal Society of Chemistry, 2015).

Έχει μοριακό βάρος 42,094 g / mol, έχει σημείο τήξεως 816 ° C και πυκνότητα 1,70 g / ml. Εάν διαλύεται στο νερό, αντιδρά με βίαια παραγωγή υδρογόνου. Αντιδρά επίσης με το αλκοόλ (Εθνικό Κέντρο Πληροφοριών για τη Βιοτεχνολογία, S.F.).
Δραστικότητα και κίνδυνοι
Το υδρίδιο του ασβεστίου είναι μια σταθερή χημική ουσία, αν και είναι πολύ αντιδραστική στο νερό ή στην υγρασία. Σε επαφή με το νερό, απελευθερώνει εύφλεκτα αέρια υδρογόνου που μπορούν να αναφλεγούν αυθόρμητα.
Θεωρείται εκρηκτική ένωση. Όταν θερμαίνεται σε αντίδραση με τετραϋδροφουράνιο, μπορεί να προκαλέσει έκρηξη. Όταν αναμιγνύεται με χλωρικό, υποχλωριώδες, βρωμικό, υπερχλωρικό κάλιο, γίνεται ευαίσθητο στη θερμότητα, τριβή και γίνεται εκρηκτικό (Hydride Calcium 7789-78-8, 2016).
Όταν το φθοριούχο άργυρο συνθλίβεται με υδρίδιο του ασβεστίου, η μάζα γίνεται πυρακτωμένη. Η ισχυρή θέρμανση του υδριδίου με χλώριο, βρώμιο ή ιώδιο οδηγεί σε πυρακτώση.
Μίγματα υδριδίου με διάφορα βρωμικά, για παράδειγμα βρωμιούχο βαρίου ή χλωρικά άλατα, για παράδειγμα χλωρικό βαρίου και υπερχλωρικά άλατα όπως υπερχλωρικό κάλιο, εκρήγνυνται κατά τη λειοτρίβηση. Το CaH2 αντιδρά πυρακτικά με φθοριούχο άργυρο εάν υπόκειται σε τριβή.
Η ένωση αυτή πρέπει να υποβληθεί σε επεξεργασία υπό αδρανή ατμόσφαιρα. Εάν δεν αντιμετωπιστεί σωστά, μπορεί να αποτελέσει σοβαρή απειλή για την υγεία και την ασφάλεια του εργαστηριακού προσωπικού, των ναυαγοσωστών και των χειριστών χημικών απορριμμάτων (Κέντρο κλινικής UC για εργαστηριακή ασφάλεια, 2013).
Εξαιρετικά επικίνδυνο σε περίπτωση επαφής με το δέρμα ή τα μάτια, καθώς είναι ερεθιστικό. Πολύ επικίνδυνο σε περίπτωση επαφής με το δέρμα, επειδή μπορεί να είναι διαβρωτικό.
Είναι επίσης επικίνδυνο σε περίπτωση κατάποσης και εισπνοής. Η ποσότητα της βλάβης του ιστού εξαρτάται από το μήκος της επαφής. Η επαφή με τα μάτια μπορεί να προκαλέσει ζημιά στον κερατοειδή ή τύφλωση.
Η επαφή με το δέρμα μπορεί να προκαλέσει φλεγμονή και φουσκάλες. Η εισπνοή σκόνης θα προκαλέσει ερεθισμό του γαστρεντερικού ή του αναπνευστικού συστήματος, που χαρακτηρίζεται από καύση, φτέρνισμα και βήχα.
Η σοβαρή υπερέκθεση μπορεί να προκαλέσει βλάβη στους πνεύμονες, ασφυξία, απώλεια αισθήσεων και ακόμη και θάνατο. Η φλεγμονή του ματιού χαρακτηρίζεται από ερυθρότητα, ερεθισμό και κνησμό. Η φλεγμονή του δέρματος χαρακτηρίζεται από φαγούρα, απολέπιση, ερυθρότητα ή περιστασιακά φουσκάλες.
Η επανειλημμένη έκθεση των ματιών σε χαμηλό επίπεδο μπορεί να προκαλέσει ερεθισμό των ματιών. Η επανειλημμένη έκθεση στο δέρμα μπορεί να προκαλέσει τοπική καταστροφή του δέρματος ή δερματίτιδα.
Επαναλαμβανόμενη εισπνοή σκόνης μπορεί να προκαλέσει διαφορετικό βαθμό ερεθισμού του αναπνευστικού συστήματος ή βλάβης των πνευμόνων. Επαναλαμβανόμενη ή παρατεταμένη εισπνοή σκόνης μπορεί να προκαλέσει χρόνιο ερεθισμό του αναπνευστικού συστήματος (Φύλλο δεδομένων ασφαλείας υλικών Υδρίδιο ασβεστίου MSDS, 2005).
Σε περίπτωση επαφής με τα μάτια, θα πρέπει να ξεπλένονται αμέσως με άφθονο νερό για τουλάχιστον 15 λεπτά, μερικές φορές ανυψώνοντας το άνω και το κάτω βλέφαρο.
Σε περίπτωση επαφής με το δέρμα πρέπει να ξεπλυθεί αμέσως με άφθονο νερό για τουλάχιστον 15 λεπτά ενώ αφαιρείτε μολυσμένα ρούχα και παπούτσια.
Σε περίπτωση κατάποσης, δεν πρέπει να προκαλείται εμετός. Θα πρέπει να κληθεί ένα κέντρο ελέγχου δηλητηριάσεων. Καλό θα είναι να αποχωρήσει από την έκθεση και να προχωρήσουμε αμέσως στον καθαρό αέρα.
Σε περίπτωση εισπνοής, εάν η αναπνοή είναι δύσκολη, είναι απαραίτητο να προμηθεύεστε οξυγόνο. Δεν πρέπει να χορηγείται αναπνοή από στόμα σε στόμα, εάν το θύμα έλαβε ή εισέβαλε στην ουσία.
Η τεχνητή αναπνοή θα πρέπει να διεγείρεται με τη βοήθεια μίας μάσκας τσέπης εξοπλισμένης με μία βαλβίδα μονής κατεύθυνσης ή άλλη κατάλληλη ιατρική αναπνευστική συσκευή. Σε όλες τις περιπτώσεις, πρέπει να ληφθεί αμέσως ιατρική φροντίδα.
Χειρισμός και αποθήκευση
Η ένωση πρέπει να διατηρείται σε ξηρό δοχείο μακριά από θερμότητα. Πρέπει να φυλάσσεται μακριά από πηγές ανάφλεξης. Μην αναπνέετε τη σκόνη. Δεν πρέπει να προστεθεί νερό σε αυτό το προϊόν
Σε περίπτωση ανεπαρκούς αερισμού, φοράτε κατάλληλο αναπνευστικό εξοπλισμό, όπως μάσκα φίλτρου. Σε περίπτωση έκθεσης, θα πρέπει να αναζητήσετε ιατρική βοήθεια και να δείξετε την ετικέτα όσο το δυνατόν περισσότερο. Αποφύγετε την επαφή με το δέρμα και τα μάτια.
Τα εύφλεκτα υλικά, γενικά, πρέπει να αποθηκεύονται σε ξεχωριστό ερμάριο ασφαλείας ή σε χώρο αποθήκευσης. Κρατήστε το δοχείο ερμητικά κλειστό.
Διατηρείτε σε δροσερό και καλά αεριζόμενο χώρο. Όλος ο εξοπλισμός που περιέχει υλικό για την αποφυγή ηλεκτρικών σπινθήρων πρέπει να είναι γειωμένος. Το δοχείο θα πρέπει να διατηρείται στεγνό και σε δροσερό μέρος.
Είναι ένα μη εύφλεκτο υλικό. Ωστόσο, οι πυροσβέστες πρέπει να φορούν τον κατάλληλο εξοπλισμό ενώ σβήνουν μια φωτιά γύρω από αυτή τη χημική ένωση.
Ποτέ δεν είναι σκόπιμο να χρησιμοποιείτε νερό για να σβήσετε μια φωτιά γύρω από το υδρίδιο του ασβεστίου. Μπορεί να χρησιμοποιηθεί ξηρή άμμος, καθώς και ενώσεις όπως χλωριούχο νάτριο και ανθρακικό νάτριο για το σκοπό αυτό.
Για την απομάκρυνση των αποβλήτων υδριδίου του ασβεστίου, πρέπει να αποσυντίθεται με την προσθήκη 25 ml μεθανόλης για κάθε γραμμάριο υδριδίου υπό ατμόσφαιρα αζώτου υπό ανάδευση.
Μόλις ολοκληρωθεί η αντίδραση, ο ίδιος όγκος νερού προστίθεται στην υδατική ένωση μεθοξείδιο ασβεστίου και εκκενώνεται στην αποστράγγιση με άφθονο νερό (Εθνικό Συμβούλιο Έρευνας, 1995)..
Χρήσεις και εφαρμογές
Αποξηραντικό μέσο
Το υδρίδιο του καλίου είναι ένα σχετικά ήπιο ξηραντικό. Λόγω αυτού του λόγου, η χρήση αυτής της ένωσης ως ξηραντικού είναι ασφαλέστερη σε σύγκριση με περισσότερους αντιδραστικούς παράγοντες, όπως κράματα νατρίου-καλίου και μεταλλικού νατρίου. Αντιδρά με το νερό με τον ακόλουθο τρόπο:
CaH2 + 2H2O → Ca (OH) 2 + 2 Η2
Τα προϊόντα υδρόλυσης της αντίδρασης αυτής, το υδρογόνο (αέριο) και το Ca (OH) 2 (ένα υδατικό μίγμα), μπορούν να διαχωριστούν από τον χημικό διαλύτη ακολουθώντας μια διαδικασία διήθησης, απόσταξης ή απόχυσης.
Αυτή η χημική ένωση είναι ένα αποτελεσματικό αποξηραντικό για πολλούς βασικούς διαλύτες όπως αμίνες και πυριδίνη. Μερικές φορές χρησιμοποιείται για την προ-ξήρανση των διαλυτών πριν από τη χρήση πιο δραστικών ξηραντικών ουσιών.
Παραγωγή υδρογόνου
Στη δεκαετία του 1940, αυτή η ένωση ήταν διαθέσιμη ως πηγή υδρογόνου υπό την εμπορική ονομασία "Hydrolith".
Έχει χρησιμοποιηθεί ως πηγή υδρογόνου για μεγάλο χρονικό διάστημα. Χρησιμοποιείται ακόμη για την παραγωγή καθαρού υδρογόνου σε εργαστήρια για διάφορα πειράματα, προηγμένες κυψέλες καυσίμου και εφαρμογές μπαταριών (American Elements, S.F.).
Η ένωση έχει χρησιμοποιηθεί ευρέως εδώ και δεκαετίες ως ασφαλές και βολικό μέσο για την εμφύσηση μπαλόνια καιρού.
Ομοίως, χρησιμοποιείται τακτικά σε εργαστήρια για την παραγωγή μικρών ποσοτήτων πολύ καθαρού υδρογόνου για πειράματα. Η περιεκτικότητα σε υγρασία του καυσίμου ντίζελ υπολογίζεται από το υδρογόνο που αναπτύσσεται μετά από επεξεργασία με CaH2.
Αναγωγικός παράγοντας
Όταν θερμαίνεται μεταξύ 600 και 1000 βαθμών Κελσίου, οξείδιο του ζιρκονίου, νιοβίου, ουρανίου, χρωμίου, τιτάνιο, βανάδιο και ταντάλιο μπορεί να μειωθεί για να παρασκευαστεί η σκόνη αυτών των μετάλλων, έτσι ώστε το υδρίδιο του ασβεστίου μπορεί να χρησιμοποιηθεί στη μεταλλουργία σκόνης.
Η ακόλουθη αντίδραση απεικονίζει τον τρόπο με τον οποίο το υδρίδιο του ασβεστίου δρα ως αναγωγικός παράγοντας:
TiO + 2CaH2 → CaO + Η2 + Ti
Μειονέκτημα στη χρήση του υδριδίου του ασβεστίου
Αυτή η χημική ένωση είναι συχνά η προτιμώμενη επιλογή ως παράγοντας ξήρανσης. Ωστόσο, έχει επίσης ορισμένα μειονεκτήματα:
-Η δράση ξήρανσης αυτής της ένωσης είναι αργή, επειδή δεν είναι διαλυτή σε κανένα διαλύτη με τον οποίο δεν αντιδρά βίαια.
-Αυτή η ένωση σε σκόνη είναι ασυμβίβαστη με πολλούς διαλύτες. Η αντίδρασή σας με χλωροάνθρακες μπορεί ακόμη και να προκαλέσει εκρήξεις.
-Δεν μπορεί να χρησιμοποιηθεί για αποξυγονωτικούς διαλύτες, αφού δεν είναι ικανός να εξαλείψει το διαλυμένο οξυγόνο.
-Η διαφοροποίηση μεταξύ υδριδίου του ασβεστίου και υδροξειδίου του ασβεστίου είναι αρκετά δύσκολη λόγω των παρόμοιων εμφανίσεών του.
Αναφορές
- Αμερικανικά Στοιχεία. (S.F.). υδρίδιο του ασβεστίου. Ανακτήθηκε από americanelements.com: americanelements.com.
- Υδρίδιο του ασβεστίου 7789-78-8. (2016). Ανακτήθηκε από το chembook.com: chembook.com.
- υδρίδιο του ασβεστίου. (s.f.). Ανακτήθηκε από μαθητευόμενο χημείας: chemistrylearner.com.
- Φύλλο δεδομένων ασφαλείας υλικού Υδατικό ασβέστιο ασβεστίου MSDS. (2005, 10 Οκτωβρίου). Ανακτήθηκε από sciencelab.com: sciencelab.com.
- Εθνικό Κέντρο Βιοτεχνολογικών Πληροφοριών. (S.F.). Δημοσιευμένη βάση δεδομένων PubChem. CID = 105052. Ανακτήθηκε από pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- εθνικό συμβούλιο έρευνας. (1995). Συνετές πρακτικές στο εργαστήριο: Χειρισμός και διάθεση χημικών ουσιών. Washinton: Εθνική Ακαδημία Τύπου.
- Βασιλική Εταιρεία Χημείας. (2015). υδρίδιο ασβεστίου ID 94784. Ανακτήθηκε από το chemspider.com: chemspider.com.
- Κέντρο UC για εργαστηριακή ασφάλεια. (2013, 18 Ιανουαρίου). πρότυπη διαδικασία λειτουργίας υδρίδιο του ασβεστίου. Ανακτήθηκε από chemengr.ucsb.edu: chemengr.ucsb.edu.


