Η δομή του αιθανίου, οι ιδιότητες, οι χρήσεις και οι κίνδυνοι
Το αιθανίου είναι ένας απλός υδρογονάνθρακας του τύπου Γ2H6 με μια φύση άχρωμου και άοσμου αερίου που έχει εξαιρετικά πολύτιμη και διαφοροποιημένη χρήση στη σύνθεση του αιθυλενίου. Επιπλέον, είναι ένα από τα επίγεια αέρια που έχει ανιχνευθεί και σε άλλους πλανήτες και αστερίσκους γύρω από το Ηλιακό Σύστημα. Ανακαλύφθηκε από τον επιστήμονα Michael Faraday το έτος 1834.
Μεταξύ του μεγάλου αριθμού των οργανικών ενώσεων που σχηματίζονται από άτομα άνθρακα και υδρογόνου (γνωστή ως υδρογονάνθρακες), υπάρχουν και εκείνοι που βρίσκονται σε αέρια κατάσταση σε θερμοκρασίες περιβάλλοντος και πιέσεις, τα οποία χρησιμοποιούνται σε πολλές βιομηχανίες σε μεγάλο βαθμό.
Αυτά συνήθως προέρχονται από το αέριο μείγμα που ονομάζεται "φυσικό αέριο", ένα προϊόν υψηλής αξίας για την ανθρωπότητα, και συνθέτουν μεθάνιο τύπου μεθάνιο, αιθάνιο, προπάνιο και βουτάνιο, μεταξύ άλλων. ταξινομημένο σύμφωνα με την ποσότητα ατόμων άνθρακα στην αλυσίδα του.
Ευρετήριο
- 1 Χημική δομή
- 1.1 Σύνθεση αιθανίου
- 2 Ιδιότητες
- 2.1 Διαλυτότητα του αιθανίου
- 2.2 Κρυστάλλωση του αιθανίου
- 2.3 Καύση αιθανίου
- 2.4 Αιθάνιο στην ατμόσφαιρα και στα ουράνια σώματα
- 3 Χρήσεις
- 3.1 Παραγωγή αιθυλενίου
- 3.2 Κατάρτιση βασικών χημικών ουσιών
- 3.3 Ψυκτικό μέσο
- 4 Κίνδυνοι από το αιθάνιο
- 5 Αναφορές
Χημική δομή
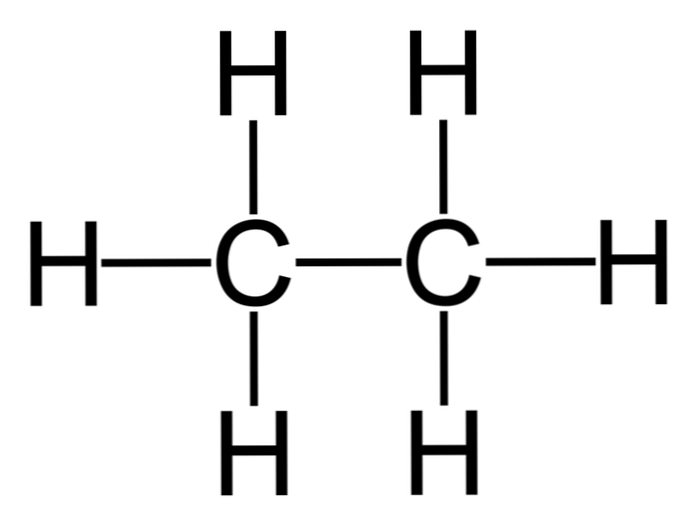
Το αιθάνιο είναι ένα μόριο του τύπου Γ2H6, τυπικά θεωρείται ως ένωση δύο μεθυλομάδων (-CH3) για να σχηματίσει τον υδρογονάνθρακα ενός απλού δεσμού άνθρακα-άνθρακα. Είναι επίσης η απλούστερη οργανική ένωση μετά το μεθάνιο, που αντιπροσωπεύεται ως εξής:
H3C-CH3
Τα άτομα άνθρακα σε αυτό το μόριο έχουν sp υβριδισμό3, έτσι ώστε οι μοριακοί δεσμοί να παρουσιάζουν ελεύθερη περιστροφή.
Επίσης, υπάρχει ένα εγγενές φαινόμενο της αιθανίου, η οποία βασίζεται στην περιστροφή της μοριακής δομής αυτής και την ελάχιστη ενέργεια που απαιτείται για να παραχθεί μία περιστροφή του συνδέσμου 360, η οποία οι επιστήμονες έχουν ονομάσει «αιθάνιο φράγμα».
Για το λόγο αυτό, το αιθάνιο μπορεί να εμφανιστεί σε διαφορετικές διαμορφώσεις ανάλογα με την περιστροφή του, αν και η πιο σταθερή διαμόρφωση του υπάρχει όπου τα υδρογόνα είναι αντίθετα μεταξύ τους (όπως φαίνεται στο σχήμα).

Σύνθεση αιθανίου
Αιθάνιο μπορεί εύκολα να συντεθεί από την ηλεκτρόλυση Kolbe, ενός οργανικού αντίδραση στην οποία συμβαίνουν δύο στάδια: ένα ηλεκτροχημικό αποκαρβοξυλίωση (απομάκρυνση της ομάδας καρβοξυλίου και απελευθέρωση διοξειδίου του άνθρακα) από δύο καρβοξυλικών οξέων, και τα προϊόντα συνδυασμού ενδιάμεσα για να σχηματίσουν έναν ομοιοπολικό δεσμό.
Παρομοίως, η ηλεκτρόλυση του οξικού οξέος οδηγεί στο σχηματισμό αιθανίου και διοξειδίου του άνθρακα και αυτή η αντίδραση χρησιμοποιείται για τη σύνθεση της πρώτης.
Η οξείδωση του οξικού ανυδρίτη με την δράση των υπεροξειδίων, μια έννοια παρόμοια με εκείνη της ηλεκτρόλυσης του Kolbe, έχει επίσης ως αποτέλεσμα τον σχηματισμό αιθανίου.
Με τον ίδιο τρόπο, μπορεί να διαχωριστεί αποτελεσματικά από το φυσικό αέριο και το μεθάνιο μέσω μιας διαδικασίας υγροποίησης, χρησιμοποιώντας κρυογονικά συστήματα για να συλλάβει αυτό το αέριο και να το διαχωρίσει από τα μείγματα με άλλα αέρια..
Η διαδικασία στροβιλοδιαστολής προτιμάται για αυτόν τον ρόλο: το μίγμα αερίων περνάει μέσω ενός στροβίλου, δημιουργώντας μια επέκταση του, έως ότου η θερμοκρασία πέσει κάτω από -100 ° C.
Ήδη σε αυτό το σημείο, τα συστατικά του μίγματος μπορούν να διαφοροποιηθούν, έτσι ώστε το υγρό αιθάνιο να διαχωριστεί από το αέριο μεθάνιο και τα άλλα είδη που εμπλέκονται με τη χρήση μιας απόσταξης.
Ιδιότητες
Το αιθάνιο εμφανίζεται στη φύση ως άοσμο και άχρωμο αέριο σε τυπικές πιέσεις και θερμοκρασίες (1 atm και 25 ° C). Έχει σημείο βρασμού -88,5 ºC και σημείο τήξης -182,8 ºC. Επιπλέον, δεν επηρεάζεται από την έκθεση σε ισχυρά οξέα ή βάσεις.
Διαλυτότητα σε αιθανόλη
Τα μόρια του αιθανίου είναι συμμετρικά διαμορφωμένα και έχουν αδύναμες δυνάμεις έλξης που τους κρατούν μαζί, που ονομάζονται δυνάμεις διασποράς.
Όταν το αιθάνιο προσπαθεί να διαλυθεί στο νερό, οι δυνάμεις έλξης που σχηματίζονται μεταξύ του αερίου και του υγρού είναι πολύ αδύναμες, έτσι ώστε να είναι πολύ δύσκολο να ενωθούν το αιθάνιο με μόρια νερού.
Για το λόγο αυτό, η διαλυτότητα του αιθανίου είναι σημαντικά χαμηλή, αυξάνοντας ελαφρά όταν αυξάνεται η πίεση του συστήματος.
Κρυστάλλωση αιθανίου
Το αιθάνιο μπορεί να στερεοποιηθεί, με αποτέλεσμα τον σχηματισμό ασταθών κρυστάλλων αιθανίου με κυβική κρυσταλλική δομή.
Με τη μείωση της θερμοκρασίας πέρα από -183,2 ° C, η δομή αυτή καθίσταται μονοκλινική, αυξάνοντας τη σταθερότητα του μορίου της.
Καύση αιθανίου
Αυτός ο υδρογονάνθρακας, παρόλο που δεν χρησιμοποιείται ευρέως ως καύσιμο, μπορεί να χρησιμοποιηθεί στις διεργασίες καύσης για την παραγωγή διοξειδίου του άνθρακα, νερού και θερμότητας, η οποία αντιπροσωπεύεται ως εξής:
2C2H6 + 7Ο2 → 4CO2 + 6Η2O + 3120 kJ
Είναι επίσης δυνατόν να κάψει αυτό το μόριο χωρίς περίσσεια οξυγόνου, η οποία είναι γνωστή ως «ατελής καύση» και καταλήγοντας στον σχηματισμό του άμορφου άνθρακα και μονοξειδίου του άνθρακα σε μια ανεπιθύμητη αντίδραση, όπως την είσοδο οξυγόνου :
2C2H6 + 3Ο2 → 4C + 6Η2O + θερμότητα
2C2H6 + 4Ο2 → 2C + 2CO + 6Η2O + θερμότητα
2C2H6 + 5Ο2 → 4CO + 6Η2O + θερμότητα
Σε αυτή την περιοχή, η καύση συμβαίνει μέσω μιας σειράς αντιδράσεων ελευθέρων ριζών, που αριθμούνται στις εκατοντάδες διαφορετικών αντιδράσεων. Για παράδειγμα, ενώσεις όπως η φορμαλδεΰδη, η ακεταλδεΰδη, το μεθάνιο, η μεθανόλη και η αιθανόλη μπορούν να σχηματιστούν σε ατελείς αντιδράσεις καύσης..
Αυτό θα εξαρτηθεί από τις συνθήκες υπό τις οποίες συμβαίνει η αντίδραση και τις αντιδράσεις των ελεύθερων ριζών. Το αιθυλένιο μπορεί επίσης να σχηματιστεί σε υψηλές θερμοκρασίες (600-900 ºC), το οποίο είναι ένα προϊόν που είναι ιδιαίτερα επιθυμητό από τη βιομηχανία.
Αιθάνιο στην ατμόσφαιρα και τα ουράνια σώματα
Ο αιθάνης υπάρχει στην ατμόσφαιρα του πλανήτη Γη σε ίχνη και υπάρχει υποψία ότι ο άνθρωπος κατάφερε να διπλασιάσει αυτή τη συγκέντρωση από τότε που άρχισε να ασκεί βιομηχανικές δραστηριότητες.
Οι επιστήμονες πιστεύουν ότι ένα μεγάλο μέρος της σημερινής παρουσίας του αιθανίου στην ατμόσφαιρα εξαιτίας της καύσης ορυκτών καυσίμων, αν και η παγκόσμια εκπομπή αιθανίου έχει μειωθεί σχεδόν κατά το ήμισυ από τις τεχνολογίες παραγωγής φυσικού αερίου σχιστόλιθου βελτιώθηκαν (το ένα πηγή φυσικού αερίου).
Αυτό το είδος παράγεται επίσης φυσικά από την επίδραση των ηλιακών ακτίνων στο ατμοσφαιρικό μεθάνιο, το οποίο ανασυνδυάζει και σχηματίζει ένα μόριο αιθανίου.
Το αιθάνιο υπάρχει σε υγρή κατάσταση στην επιφάνεια του Τιτάνα, ένα από τα φεγγάρια του Κρόνου. Αυτό συμβαίνει σε μεγαλύτερη ποσότητα στον ποταμό Vid Flumina, ο οποίος ρέει για περισσότερα από 400 χιλιόμετρα προς μία από τις θάλασσές του. Αυτή η ένωση έχει επίσης καταδειχθεί στους κομήτες και στην επιφάνεια του Πλούτωνα.
Χρησιμοποιεί
Παραγωγή αιθυλενίου
Η χρήση του αιθανίου βασίζεται κυρίως στην παραγωγή αιθυλενίου, του πλέον χρησιμοποιούμενου οργανικού προϊόντος στην παγκόσμια παραγωγή, μέσω μιας διαδικασίας γνωστής ως πυρόλυση με ατμό..
Αυτή η διαδικασία συνίσταται στη διέλευση μιας τροφοδοσίας από αιθάνιο αραιωμένο με ατμό σε ένα φούρνο, το οποίο θερμαίνεται γρήγορα χωρίς οξυγόνο.
Η αντίδραση συμβαίνει σε εξαιρετικά υψηλή θερμοκρασία (μεταξύ 850 και 900 ºC), αλλά ο χρόνος παραμονής (ο χρόνος που καταναλώνεται από το αιθάνιο μέσα στον φούρνο) πρέπει να είναι σύντομος για να είναι αποτελεσματική η αντίδραση. Σε υψηλότερες θερμοκρασίες, παράγεται περισσότερο αιθυλένιο.
Εκπαίδευση βασικών χημικών ουσιών
Το αιθάνιο έχει επίσης μελετηθεί ως κύριο συστατικό στο σχηματισμό βασικών χημικών ουσιών. Η οξειδωτική χλωρίωση είναι μία από τις μεθόδους που προτείνονται για τη λήψη χλωριούχου βινυλίου (ένα συστατικό του PVC), αντικαθιστώντας λιγότερο δαπανηρές και πιο περίπλοκες.
Ψυκτικό μέσο
Τέλος, το αιθάνιο χρησιμοποιείται ως ψυκτικό μέσο σε κοινά κρυογονικά συστήματα, δείχνοντας επίσης την ικανότητα να παγώνει μικρά δείγματα στο εργαστήριο για ανάλυση.
Είναι πολύ καλό υποκατάστατο για το νερό, το οποίο απαιτεί περισσότερο χρόνο για να κρυώσει τα ευαίσθητα δείγματα και μπορεί επίσης να δημιουργήσει το σχηματισμό επιβλαβών κρυστάλλων πάγου.
Κίνδυνοι αιθάνης
-Το αιθάνιο έχει την ικανότητα να αναφλέγεται, ειδικά όταν δεσμεύεται με αέρα. Σε ποσοστά 3,0 έως 12,5% όγκου αιθανίου στον αέρα, μπορεί να σχηματιστεί ένα εκρηκτικό μείγμα.
-Μπορεί να περιορίσει το οξυγόνο στον αέρα στον οποίο βρίσκεται και γι 'αυτό παρουσιάζει έναν παράγοντα κινδύνου ασφυξίας για ανθρώπους και ζώα που είναι παρόντα και εκτεθειμένα.
-Το αιθάνιο σε κατεψυγμένη υγρή μορφή μπορεί να καεί σοβαρά το δέρμα εάν έρχεται σε άμεση επαφή με αυτό, και επίσης να ενεργεί ως κρυογονικό μέσο για οποιοδήποτε αντικείμενο αγγίζει, να το παγώσει σε στιγμές.
-Οι ατμοί υγρού αιθανίου είναι βαρύτεροι από τον αέρα και συγκεντρώνονται στο έδαφος, αυτό μπορεί να παρουσιάσει κίνδυνο ανάφλεξης που μπορεί να προκαλέσει αντίδραση καύσης αλύσου.
-Η κατάποση αιθανίου μπορεί να προκαλέσει ναυτία, έμετο και εσωτερική αιμορραγία. Η εισπνοή, εκτός από την ασφυξία, προκαλεί πονοκεφάλους, σύγχυση και μεταβολές της διάθεσης. Ο θάνατος λόγω καρδιακής ανακοπής είναι δυνατός σε υψηλές εκθέσεις.
-Αντιπροσωπεύει ένα αέριο θερμοκηπίου το οποίο, μαζί με το μεθάνιο και το διοξείδιο του άνθρακα, συμβάλλει στην υπερθέρμανση του πλανήτη και στην αλλαγή του κλίματος που προκαλείται από την ανθρώπινη ρύπανση. Ευτυχώς, είναι λιγότερο άφθονο και ανθεκτικό από το μεθάνιο και απορροφά λιγότερη ακτινοβολία από αυτό.
Αναφορές
- Britannica, Ε. (S.f.). Αιθάνιο. Ανακτήθηκε από britannica.com
- Nes, G.V. (s.f.). Μονοκρυσταλικές δομές και κατανομές πυκνότητας ηλεκτρονίων αιθανίου, αιθυλενίου και ακετυλενίου. Ανάκτηση από rug.nl
- Sites, G. (s.f.). Αιθάνιο: Πηγές και νεροχύτες. Ανακτήθηκε από το site.google.com
- SoftSchools. (s.f.). Τύπος αιθανίου. Ανάκτηση από το softschools.com
- Wikipedia. (s.f.). Αιθάνιο. Ανακτήθηκε από en.wikipedia.org


