Ενέργεια Χημικής Ενεργοποίησης Τι Περιλαμβάνει Υπολογισμός
Το ενέργεια χημικής ενεργοποίησης (από την άποψη των κινητικών μελετών) αναφέρεται στην ελάχιστη δυνατή ποσότητα ενέργειας που απαιτείται για την έναρξη μιας χημικής αντίδρασης. Σύμφωνα με τη θεωρία των συγκρούσεων στη χημική κινητική, λέγεται ότι όλα τα μόρια που βρίσκονται σε κίνηση έχουν μια ορισμένη ποσότητα κινητικής ενέργειας.
Αυτό σημαίνει ότι όσο μεγαλύτερη είναι η ταχύτητα της κίνησης σας, τόσο μεγαλύτερη είναι η κινητική σας ενέργεια. Υπό αυτή την έννοια, ένα μόριο που φέρει μια γρήγορη κίνηση δεν μπορεί να χωριστεί σε θραύσματα από μόνο του, έτσι πρέπει να συμβεί μια σύγκρουση μεταξύ αυτού και άλλου μορίου έτσι ώστε να μπορεί να συμβεί μια χημική αντίδραση.
Όταν συμβαίνει αυτό - όταν συμβαίνει σύγκρουση μεταξύ των μορίων - ένα κλάσμα της κινητικής του ενέργειας μετατρέπεται σε δονητική ενέργεια. Ομοίως, αν στην αρχή της διαδικασίας η κινητική ενέργεια είναι υψηλή, τα μόρια που συμμετέχουν στη σύγκρουση θα παρουσιάσουν μια δόνηση τόσο μεγάλη ώστε ορισμένοι από τους χημικούς δεσμούς που υπάρχουν θα σπάσουν..
Αυτό το σπάσιμο των δεσμών είναι το πρώτο βήμα για τη μετατροπή των αντιδραστηρίων σε προϊόντα. δηλαδή, στο σχηματισμό αυτών. Από την άλλη πλευρά, εάν στην αρχή αυτής της διαδικασίας η κινητική ενέργεια είναι μικρού μεγέθους, θα υπάρξει ένα φαινόμενο "ανάκαμψης" των μορίων, μέσω του οποίου θα χωριστούν πρακτικά ανέπαφα..
Ευρετήριο
- 1 Από τι συνίσταται;?
- 1.1 Ενεργοποιημένο σύμπλεγμα
- 2 Πώς υπολογίζεται?
- 2.1 Υπολογισμός της ενέργειας ενεργοποίησης μιας χημικής αντίδρασης
- 3 Πώς επηρεάζει η ενέργεια ενεργοποίησης την ταχύτητα μιας αντίδρασης?
- 4 Παραδείγματα υπολογισμού ενέργειας ενεργοποίησης
- 5 Αναφορές
Από τι συνίσταται;?
Αρχίζοντας από την έννοια των συγκρούσεων μεταξύ των μορίων για την έναρξη των χημικών αντιδράσεων που περιγράφηκαν προηγουμένως, μπορεί να ειπωθεί ότι υπάρχει μια ελάχιστη ποσότητα ενέργειας που απαιτείται για να συμβεί μια σύγκρουση.
Έτσι, αν η θερμιδική αξία είναι μικρότερη από την ελάχιστη απαιτούμενη, απλά δεν θα υπάρχει μεταβολή μεταξύ των μορίων μετά την υποβολή της σύγκρουσης, πράγμα που σημαίνει ότι όταν αυτή η ενέργεια είναι απούσα, τα είδη που εμπλέκονται παραμένουν σε μεγάλο βαθμό ανέπαφο και δεν θα συμβεί οποιαδήποτε αλλαγή οφείλεται σε αυτό το σοκ.
Σε αυτή τη σειρά ιδεών, η ελάχιστη ενέργεια που απαιτείται για να συμβεί μια αλλαγή μετά από μια σύγκρουση μεταξύ μορίων ονομάζεται ενέργεια ενεργοποίησης.
Με άλλα λόγια, τα μόρια που εμπλέκονται σε ένα σοκ πρέπει να έχουν μια ποσότητα ολικής κινητικής ενέργειας με μέγεθος ίσο ή μεγαλύτερο από την ενέργεια ενεργοποίησης έτσι ώστε να μπορεί να συμβεί μια χημική αντίδραση.
Επίσης, σε πολλές περιπτώσεις τα μόρια συγκρούονται και προέρχονται από ένα νέο είδος που ονομάζεται ενεργοποιημένο σύμπλοκο, δομή που ονομάζεται επίσης "κατάσταση μετάβασης" επειδή υπάρχει μόνο προσωρινά.
Προκαλείται από τα αντιδρώντα είδη λόγω της σύγκρουσης και πριν από το σχηματισμό των προϊόντων της αντίδρασης.
Ενεργοποιημένο σύμπλεγμα
Το ενεργοποιημένο σύμπλεγμα που αναφέρθηκε παραπάνω αποτελεί ένα είδος που έχει πολύ χαμηλή σταθερότητα αλλά το οποίο, με τη σειρά του, έχει μια μεγάλη ποσότητα δυνητικής ενέργειας.
Το ακόλουθο διάγραμμα δείχνει τον μετασχηματισμό των αντιδραστηρίων σε προϊόντα, που εκφράζονται σε όρους ενέργειας και επισημαίνοντας ότι το μέγεθος της ενέργειας του ενεργοποιημένου συμπλόκου που σχηματίζεται είναι σημαντικά μεγαλύτερο από αυτό των αντιδραστηρίων και των προϊόντων..
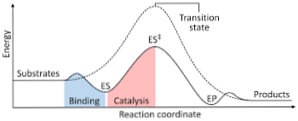
Εάν στο τέλος της αντίδρασης τα προϊόντα έχουν μεγαλύτερη σταθερότητα από ότι οι αντιδραστικές ουσίες, η απελευθέρωση ενέργειας λαμβάνει χώρα με τη μορφή θερμότητας, δίνοντας μια εξωθερμική αντίδραση..
Αντίθετα, εάν τα αντιδραστήρια καταλήξουν σε σταθερότητα μεγαλύτερης από τα προϊόντα, αυτό σημαίνει ότι το μίγμα αντίδρασης εκδηλώνει απορρόφηση ενέργειας με τη μορφή θερμότητας από το περιβάλλον του, με αποτέλεσμα μια ενδοθερμική αντίδραση..
Ομοίως, εάν συμβαίνει μία περίπτωση ή η άλλη, πρέπει να κατασκευαστεί ένα διάγραμμα, όπως αυτό που παρουσιάστηκε προηγουμένως, όπου απεικονίζεται η πιθανή ενέργεια του συστήματος που αντιδρά έναντι της προόδου ή της εξέλιξης της αντίδρασης..
Με αυτόν τον τρόπο, επιτυγχάνονται οι δυναμικές αλλαγές ενέργειας που συμβαίνουν καθώς συνεχίζεται η αντίδραση και τα αντιδραστήρια μετατρέπονται σε προϊόντα.
Πώς υπολογίζεται?
Η ενέργεια ενεργοποίησης μιας χημικής αντίδρασης σχετίζεται στενά με τη σταθερά ταχύτητας αυτής της αντίδρασης και η εξάρτηση αυτής της σταθεράς από τη θερμοκρασία αντιπροσωπεύεται από την εξίσωση Arrhenius:
k = Ae-Ea / RT
Σε αυτή την έκφραση k αντιπροσωπεύει τη σταθερά ταχύτητας της αντίδρασης (η οποία εξαρτάται από τη θερμοκρασία) και την παράμετρο Α ονομάζεται συντελεστής συχνότητας και είναι ένα μέτρο της συχνότητας των συγκρούσεων μεταξύ των μορίων.
Από τη μεριά του, ε εκφράζει τη βάση της σειράς φυσικών λογαρίθμων. Αυξάνεται σε ισχύ ίση με το αρνητικό πηλίκο της ενέργειας ενεργοποίησης (Εα) μεταξύ του προϊόντος που προκύπτει από τη σταθερά αερίου (R) και την απόλυτη θερμοκρασία (Τ) του συστήματος να εξετάσει.
Πρέπει να σημειωθεί ότι ο συντελεστής συχνότητας μπορεί να θεωρηθεί ως σταθερά σε ορισμένα συστήματα αντίδρασης σε ένα ευρύ φάσμα θερμοκρασιών.
Αυτή η μαθηματική έκφραση υποστηρίχτηκε αρχικά από την ολλανδική-γεννημένος χημικός Ιάκωβος Ερρίκος βαν'τ Χοφ το 1884, αλλά ποιος έδωσε την επιστημονική εγκυρότητα και την ερμηνεία σκεπτικό της ήταν ο Σουηδός χημικός Svante Arrhenius προέλευσης, το 1889.
Υπολογισμός της ενέργειας ενεργοποίησης μιας χημικής αντίδρασης
Η εξίσωση Arrhenius επισημαίνει την άμεση αναλογικότητα που υπάρχει μεταξύ της σταθεράς ταχύτητας μιας αντίδρασης και της συχνότητας των συγκρούσεων μεταξύ των μορίων.
Επίσης, αυτή η εξίσωση μπορεί να εκπροσωπείται με έναν πιο βολικό τρόπο, εφαρμόζοντας την ιδιότητα των φυσικών λογαρίθμων σε κάθε πλευρά της εξίσωσης, λαμβάνοντας:
ln k = ln A - Ea / RT
Κατά την αναδιάταξη των όρων προκειμένου να ληφθεί η εξίσωση μιας γραμμής (y = mx + b), επιτυγχάνεται η ακόλουθη έκφραση:
lnk = (- Ea / R) (1 / Τ) + Ιη Α
Έτσι, κατά την κατασκευή ενός οικόπεδο ln k κατά 1 / Τ μια ευθεία γραμμή, όπου ln k λαμβάνεται αντιπροσωπεύει το y συντεταγμένη, (-Ea / R) αντιπροσωπεύει την κλίση της γραμμής (m), (1 / Τ) αντιπροσωπεύει η x συντεταγμένη, και ln ένα αντιπροσωπεύει την διασταύρωση με τον άξονα y (b).
Όπως μπορεί να φανεί, η κλίση που προκύπτει από αυτόν τον υπολογισμό είναι ίση με την τιμή -Ea / R. Αυτό σημαίνει ότι, αν είναι επιθυμητή η απόκτηση της τιμής της ενέργειας ενεργοποίησης μέσω αυτής της έκφρασης, θα πρέπει να γίνει μια απλή εκκαθάριση, με αποτέλεσμα:
Ea = -mR
Εδώ γνωρίζουμε την τιμή του m και το R είναι μια σταθερά ίση με 8.314 J / K · mol.
Πώς επηρεάζει η ενέργεια ενεργοποίησης την ταχύτητα μιας αντίδρασης?
Όταν προσπαθεί να κάνει μια εικόνα της ενέργειας ενεργοποίησης, μπορεί να θεωρηθεί ως ένα εμπόδιο που δεν επιτρέπει την εμφάνιση μιας αντίδρασης μεταξύ των κατώτερων ενεργειακών μορίων.
Όπως σε μια κοινή αντίδραση συμβαίνει ότι ο αριθμός των μορίων που μπορούν να αντιδράσουν είναι αρκετά μεγάλος, η ταχύτητα - και ισοδύναμα, η κινητική ενέργεια αυτών των μορίων - μπορεί να είναι πολύ μεταβλητή.
Αυτό συμβαίνει συνήθως, μόνο ένα μειωμένο ποσό του συνόλου των μορίων εμφανίσουν -το σύγκρουση που διαθέτουν πιο γρήγορα Κίνηση έχουν αρκετή κινητική ενέργεια για να ξεπεράσει το μέγεθος της ενέργειας ενεργοποίησης. Έτσι, αυτά τα μόρια είναι ικανά και ικανά να είναι μέρος της αντίδρασης.
Σύμφωνα με την εξίσωση Arrhenius, το αρνητικό πρόσημο που προηγείται της αναλογίας μεταξύ της ενέργειας ενεργοποίησης και το προϊόν της σταθεράς αερίου από την απόλυτη θερμοκρασία συνεπάγεται ότι οι σταθερό ρυθμό μείωσης δώρα έχοντας μια αύξηση στην ενέργεια ενεργοποίησης, καθώς και μια αύξηση όταν η θερμοκρασία αυξάνεται.
Παραδείγματα υπολογισμού της ενέργειας ενεργοποίησης
Για τον υπολογισμό της ενέργειας ενεργοποίησης κατασκευάζοντας ένα γράφημα, σύμφωνα με την εξίσωση Arrhenius, πρέπει να είναι οι σταθερές ρυθμού για την αντίδραση αποσύνθεσης της ακεταλδεΰδης μετρήθηκαν σε πέντε διαφορετικές θερμοκρασίες και είναι επιθυμητό να προσδιοριστεί η ενέργεια ενεργοποίησης για την αντίδραση, η οποία εκφράζεται ως:
CH3CHO (g) → CH4(g) + CO (g)
Τα δεδομένα των πέντε μετρήσεων είναι τα ακόλουθα:
k (1 / Μ1/2· S): 0,011-0,035-0,105-0,343-0,789
Τ (Κ): 700 - 730 - 760 - 790 - 810
Πρώτον, για να λύσει αυτό το μυστήριο και να καθορίσει την ενέργεια ενεργοποίησης είναι η δημιουργία μιας οικόπεδο ln k vs 1 / Τ (y vs x) για να ληφθεί μια ευθεία γραμμή και από εδώ λαμβάνουν την κλίση και να βρει την αξία των Ea, όπως εξηγείται.
Μετασχηματίζοντας τα δεδομένα των μετρήσεων, σύμφωνα με την εξίσωση Arrhenius [ln k = (- Ea / R) (1 / T) + ln A], βρέθηκαν οι ακόλουθες τιμές για το y και το x, αντίστοιχα:
lnk: (-4.51) - (-3.35) - (-2.254) - (-1.070) - (-0.237)
1 / Τ (Κ-1): 1,43 * 10-3 - 1,37 * 10-3 - 1,32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Από αυτές τις τιμές και μέσω του μαθηματικού υπολογισμού της κλίσης - είτε σε έναν υπολογιστή είτε σε έναν υπολογιστή, μέσω της έκφρασης m = (Y2-Υ1) / (Χ2-Χ1) ή χρησιμοποιώντας τη μέθοδο γραμμικής παλινδρόμησης - έχουμε ότι m = -Ea / R = -2.09 * 104 K. Λοιπόν:
Ea = (8.314 J / K · mol) (2.09 * 104 Κ)
= 1,74 * 105 = 1,74 * 102 kJ / mol
Για τον προσδιορισμό άλλων ενεργειών ενεργοποίησης μέσω του γραφικού τρόπου, πραγματοποιείται μια παρόμοια διαδικασία.
Αναφορές
- Wikipedia. (s.f.). Ενέργεια ενεργοποίησης. Ανακτήθηκε από en.wikipedia.org
- Chang, R. (2007). Chemistry, Ninth edition. Μεξικό: McGraw-Hill.
- Britannica, Ε. (S.f.). Ενεργοποίηση ενέργειας. Ανακτήθηκε από britannica.com
- Moore, J. W. και Pearson, R. G. (1961). Κινητική και μηχανισμός. Ανακτήθηκε από το books.google.co.ve
- Kaesche, Η. (2003). Διάβρωση των μετάλλων: φυσικοχημικές αρχές και τρέχοντα προβλήματα. Ανακτήθηκε από το books.google.co.ve


