Διχρωματικές ιδιότητες νατρίου, παραγωγή, κίνδυνοι και χρήσεις
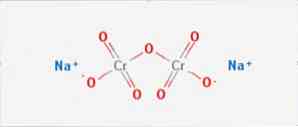
Το διχρωμικό νάτριο είναι μια ανόργανη ένωση του τύπου Na2Cr2O7. Είναι μια από τις πολλές ενώσεις εξασθενούς χρωμίου (Cr VI). Η δομή του απεικονίζεται στο σχήμα 1, αν και συνήθως το άλας διαχειρίζεται στην διυδατωμένη του μορφή του οποίου ο τύπος θα είναι Na2Cr2O7 · H2O.
Έχει δύο ιονικούς δεσμούς μεταξύ των μορίων νατρίου και των αρνητικά φορτισμένων οξυγόνων. Το μετάλλευμα χρωμίου εκχυλίζεται από διχρωμικό νάτριο. Ετησίως παράγονται εκατομμύρια χιλιόγραμμα διχρωμικού νατρίου.
Η Κίνα είναι ο μεγαλύτερος παραγωγός διχρωμικού νατρίου, ωστόσο τα κινεζικά χημικά εργοστάσια έχουν σχετικά χαμηλή παραγωγή, λιγότερα από 50.000 τόνους το καθένα, σε σύγκριση με το εργοστάσιο του Καζακστάν που παράγει πάνω από 100.000 τόνους ετησίως.
Τα φυτά στη Ρωσία, τις Ηνωμένες Πολιτείες και το Ηνωμένο Βασίλειο έχουν μια ενδιάμεση παραγωγή μεταξύ 50.000 και 100.000 τόνων ετησίως (Kogel, 2006).
Από την άποψη της αντιδραστικότητας και την εμφάνιση, διχρωμικό νάτριο έχει παρόμοιες ιδιότητες διχρωμικό κάλιο, ωστόσο, το άλας νατρίου είναι περισσότερο διαλυτό στο νερό και έχει ένα ισοδύναμο βάρος στο άλας καλίου.
Το διχρωμικό νάτριο παράγει τοξικούς ατμούς χρωμίου όταν θερμαίνεται. Είναι ισχυρός οξειδωτικός παράγοντας και είναι πολύ διαβρωτικός.
Αυτή η ένωση μπορεί να βρεθεί στο πόσιμο πηγές νερού μολυσμένου με βιομηχανικές διεργασίες και τεχνικές γαλβανισμένα ή ηλεκτρολυτικής, βυρσοδεψία και την κατασκευή κλωστοϋφαντουργικών.
Ευρετήριο
- 1 Φυσικές και χημικές ιδιότητες
- 2 Μέθοδοι παραγωγής
- 3 Δραστικότητα και κίνδυνοι
- 4 Χρήσεις και εφαρμογές
- 5 Βιοχημεία
- 6 Αναφορές
Φυσικές και χημικές ιδιότητες
διχρωμικό νάτριο αποτελείται από μονοκλινικής κρυστάλλων κοκκινωπό πορτοκαλί στην άνυδρη μορφή του και στερείται της όσφρησης. μοριακό βάρος του είναι 261.97 g / mol στην άνυδρη μορφή του και 298,00 g / mol σε διυδρική μορφή του.
Έχει σημείο τήξης 356,7 βαθμούς Κελσίου, σημείο βρασμού 400 βαθμών Κελσίου, στο οποίο αποσυντίθεται. Έχει πυκνότητα 2,52 g / ml.

Το Σχήμα 2 δείχνει την εμφάνιση της διχρωμικό νάτριο παρουσιάζεται. Η διαλυτότητά του στο νερό είναι 187 g ανά 100 γραμμάρια στους 25 βαθμούς Κελσίου και η διαλυτότητα της σε αιθανόλη είναι 513.2 γραμμάρια ανά λίτρο έως 19,4 βαθμούς Κελσίου (National Center for Biotechnology Information, S. F.).
Θεωρείται σταθερή ένωση εάν φυλάσσεται υπό τις συνιστώμενες συνθήκες και δεν είναι εύφλεκτη. Επειδή είναι ισχυρός οξειδωτικός παράγων, είναι διαβρωτικός και σε διάλυμα είναι οξύ που έχει την ικανότητα να μειώνει το ρΗ σε 4 σε ένα διάλυμα 1% β / ο.
Μέθοδοι παραγωγής
Το χρωμικό νάτριο μπορεί να μετατραπεί σε διχρωμικό μέσω μιας συνεχούς διαδικασίας που επεξεργάζεται με θειικό οξύ, διοξείδιο του άνθρακα ή συνδυασμό αυτών των δύο.
Η εξάτμιση του υγρού διχρωμικού νατρίου προκαλεί την καταβύθιση θειικού νατρίου ή / και όξινου ανθρακικού νατρίου και οι ενώσεις αυτές απομακρύνονται πριν από την τελική κρυστάλλωση διχρωμικού νατρίου..
Το διχρωμικό νάτριο μπορεί να γίνει σε μια διαδικασία τριών σταδίων:
- Αλκαλικό ψήσιμο χρωμιτικών συνθηκών οξείδωσης
- Εκχύλιση. Εκχύλιση της διαλυτής ύλης από ένα μείγμα με τη δράση ενός υγρού διαλύτη
- Μετατροπή μονοχρωμικού νατρίου σε διχρωμικό νάτριο μέσω οξέος.
Άνυδρο διχρωμικό νάτριο μπορεί να παρασκευαστεί με τήξη διένυδρο διχρωμικό νάτριο, κρυστάλλωση υδατικά διαλύματα διχρωμικού παραπάνω από 86 βαθμούς C, ή ξήρανση διαλύματα διχρωμικού νατρίου σε ξηραντήρες ψεκασμού.
Τα διαλύματα διχρωμικού νατρίου σε 69 και 70% νν / ν που χρησιμοποιείται ως μια βολική και οικονομικά αποδοτική μέθοδο για την αποστολή ποσών, αποφεύγοντας την ανάγκη για χειρωνακτική διακίνηση ή διάλυση των κρυστάλλων.
Δραστικότητα και κίνδυνοι
Είναι ένας ισχυρός παράγοντας οξείδωσης. Ασύμβατο με ισχυρά οξέα. Η επαφή με εύφλεκτα υλικά μπορεί να προκαλέσει πυρκαγιές. Τοξικοί ατμοί οξειδίου του χρωμίου μπορούν να σχηματιστούν παρουσία θερμότητας ή φωτιάς.
Το γνωστό "μείγμα χρωμικού οξέος" διχρωμικού και θειικού οξέος με οργανικά υπολείμματα προκαλεί βίαιη εξωθερμική αντίδραση. Αυτό το μίγμα σε συνδυασμό με υπολείμματα ακετόνης οδηγεί επίσης σε βίαιη αντίδραση.
Ο συνδυασμός διχρωμικού και θειικού οξέος με αλκοόλες, αιθανόλη και 2-προπανόλη, προκαλεί βίαιη εξωθερμική αντίδραση. Λόγω της εμφάνισης πολλών περιστατικών που συνεπάγονται την ανάμιξη διχρωμικού-θειικού οξέος με οξειδώσιμα οργανικά υλικά, είναι πιθανότατα καλύτερα να αποφεύγονται τέτοιες αλληλεπιδράσεις.
Ο συνδυασμός διχρωμικού με υδραζίνη είναι εκρηκτικός, η αντίδραση διχρωμικού μπορεί να αναμένεται να είναι έντονη με αμίνες γενικά. Η προσθήκη του αφυδατωμένου διχρωμικού άλατος σε οξικό ανυδρίτη οδηγεί σε τελικά εκρηκτική εξωθερμική αντίδραση.
Το βόριο, το πυρίτιο και τα διχρωμικά σχηματίζουν πυροτεχνικά μίγματα. Ένα μίγμα από οξικό οξύ, 2-μεθυλο-2-πεντενάλη και διχρωμικό άλας οδηγεί σε μία ανεξέλεγκτη αντίδραση (Dichromate Sodium Dichromate, 2016).
Η εισπνοή σκόνης ή ομίχλης προκαλεί ερεθισμό του αναπνευστικού συστήματος που μερικές φορές μοιάζει με το άσθμα. Μπορεί να εμφανιστεί διάτρηση διάφραγμα. Θεωρείται δηλητήριο.
Η κατάποση προκαλεί εμετό, διάρροια και, πολύ ασυνήθιστα, επιπλοκές του στομάχου και των νεφρών. Η επαφή με τα μάτια ή το δέρμα προκαλεί τοπικό ερεθισμό. Η επανειλημμένη έκθεση στο δέρμα προκαλεί δερματίτιδα.
Το διχρωμικό νάτριο είναι καρκινογόνο στους ανθρώπους. Υπάρχουν στοιχεία ότι οι ενώσεις εξασθενούς χρωμίου ή Cr (VI) μπορούν να προκαλέσουν καρκίνο του πνεύμονα στους ανθρώπους. Έχει αποδειχθεί ότι το διχρωμικό νάτριο προκαλεί καρκίνο του πνεύμονα στα ζώα.
Ενώ διχρωμικό νάτριο δεν έχει ταυτοποιηθεί ως ένωση τερατογόνος ή την αναπαραγωγική κινδύνου, είναι γνωστό ότι οι ενώσεις του εξασθενούς χρωμίου Cr (VI) είναι τερατογόνα και προκαλούν αναπαραγωγική βλάβη και να μειώσουν τη γονιμότητα και να παρεμβαίνει με εμμηνορροϊκούς κύκλους.
Το διχρωμικό νάτριο μπορεί να προκαλέσει βλάβη στο ήπαρ και στα νεφρά, γι 'αυτό πρέπει να αντιμετωπιστεί με μεγάλη προσοχή (New Jersey Department of Health, 2009).
Σε περίπτωση κατάποσης, το θύμα πρέπει να πίνει νερό ή γάλα. Μην προκαλείτε εμετό. Σε περίπτωση επαφής με το δέρμα ή τα μάτια πρέπει να αντιμετωπίζονται ως όξινα εγκαύματα. Ξεπλύνετε τα μάτια σας με νερό για τουλάχιστον 15 λεπτά.
Οι εξωτερικές βλάβες μπορούν να τριφτούν με διάλυμα θειοθειικού νατρίου 2%. Σε όλες τις περιπτώσεις, πρέπει να συμβουλευτείτε έναν γιατρό.
Χρήσεις και εφαρμογές
Εκτός από τη σημασία της στην κατασκευή άλλων χημικών ουσιών χρωμίου, το διχρωμικό νάτριο έχει επίσης πολλές άμεσες χρήσεις ως συστατικό στην παραγωγή:
- Το μεταλλικό φινίρισμα: βοηθά στην αντοχή στη διάβρωση και καθαρίζει τις μεταλλικές επιφάνειες, ευνοεί επίσης την πρόσφυση του χρώματος.
- Οργανικά προϊόντα: χρησιμοποιούνται ως οξειδωτικά μέσα στην παρασκευή προϊόντων όπως η βιταμίνη Κ και ο κηρός.
- Χρωστικές: χρησιμοποιούνται στην κατασκευή ανόργανων χρωμικών χρωστικών, όπου παράγει μια ποικιλία χρωμάτων σταθερών στο φως. Ορισμένες ποιότητες χρωμικού χρησιμοποιούνται επίσης ως αναστολείς διάβρωσης στα κατώτερα στρώματα και τους εκκινητές.
- Κεραμικά: χρησιμοποιούνται για την παρασκευή χρωματιστών ποτηριών και κεραμικών γυαλιών.
- Κλωστοϋφαντουργία: χρησιμοποιείται ως μέσο πρόσφυσης για όξινες βαφές για να βελτιώσει τις ιδιότητες ταχείας χρωματισμού.
- Παραγωγή θειικού χρωμίου.
(Διχρωμικό νάτριο, το δομικό στοιχείο για όλες σχεδόν τις άλλες ενώσεις χρωμίου., 2010-2012)
Διϋδρικό διχρωμικό νάτριο, η χρήση του είναι ιδανική σε διάφορες συνθήκες, συμπεριλαμβανομένων εφαρμογών υψηλής θερμοκρασίας, όπως κεραμικά υαλοστάσια και χρωματισμένο γυαλί.
Χρωμικου οξειδίου, όντας πιο δύσκολο από ό άλλα οξείδια μετάλλων, όπως τιτάνιο ή σίδηρος είναι ιδανική για περιβάλλοντα όπου οι συνθήκες θερμοκρασίας και η διαδικασία είναι επιθετικοί.
Η ουσία αυτή χρησιμοποιείται κυρίως για την παραγωγή άλλων ενώσεων χρωμίου, αλλά χρησιμοποιείται επίσης σε λάσπες μπεντονίτη που χρησιμοποιούνται στην παραγωγή ελαίου, σε συντηρητικά ξύλου, στην παραγωγή οργανικών χημικών ουσιών και ως αναστολέα διάβρωσης..
Όταν αναμειγνύεται με αλουμίνιο και διχρωμικό κάλιο, χρησιμοποιώντας την αλουμινο-θερμική επεξεργασία, το χρωμικό οξείδιο παράγει μεταλλικό χρώμιο υψηλής καθαρότητας. Αυτό είναι ένα ζωτικό συστατικό στην παραγωγή υπερκραμάτων υψηλής απόδοσης που χρησιμοποιούνται στην αεροδιαστημική βιομηχανία.
Στην οργανική σύνθεση, το διχρωμικό νάτριο χρησιμοποιείται ως οξειδωτικό μέσο σε αντιδράσεις οξειδίου αναγωγής παρουσία θειικού οξέος.
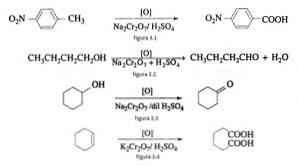
Για παράδειγμα, η οξείδωση του ρ-νιτροτολουολίου να σχηματίσουν ρ-νιτροβενζοϊκό οξύ, στην οξείδωση του π-βουτανόλη για να σχηματίσει Ν-butaldehido, στο σχηματισμό κυκλοεξανόνης από κυκλοεξανόλη και το σχηματισμό αδιπικού οξέος όπως απεικονίζεται στα Σχήματα 3.1 , 3.2, 3.3 και 3.4 αντίστοιχα (VK Ahluwalia, 2004).
Βιοχημεία
Η ενδοτραχειακή ενστάλαξη του διχρωμικού νατρίου (CrVI) και υδροξείδιο του οξικού χρωμίου (CrIII) σε αρσενικούς αρουραίους οδήγησε σε αυξημένες συγκεντρώσεις του χρωμίου είναι πλήρες αίμα, το πλάσμα και τα ούρα μέχρι 72 ώρες μετά την έκθεση? Οι μέγιστες συγκεντρώσεις επιτεύχθηκαν στις 6 ώρες μετά την έκθεση.
Η αναλογία μεταξύ συγκεντρώσεων χρωμίου ολικού αίματος και χρωμίου πλάσματος ήταν σημαντικά διαφορετική για τις επεξεργασίες Cr (VI) και Cr (III). Επομένως, για την αξιολόγηση της έκθεσης χρωμίου πρέπει να χρησιμοποιούνται αναλύσεις χρωμίου στο αίμα και χρωμίου στο πλάσμα.
Το χρώμιο ανιχνεύθηκε επίσης στα περιφερικά λεμφοκύτταρα. Cr (VI), αλλά όχι το Cr (III) συσσωρεύτηκε σημαντικά στα λεμφοκύτταρα μετά τη θεραπεία. Αυτά τα κύτταρα έχουν τη δυνατότητα να χρησιμοποιηθούν ως βιοδείκτες στην αξιολόγηση της έκθεσης σε ενώσεις χρωμίου (Hooth, 2008).
Αναφορές
- Χημικό δελτίο Διχρωμικό νάτριο. (2016). Ανακτήθηκε από χημικές ουσίες καμεών: cameochemicals.noaa.
- Hooth, Μ. J. (2008). Τεχνική έκθεση για μελέτες τοξικολογίας και καρκινογένεσης διϋδρογόνου νατρίου διυδροποιημένου. Εθνικό Ινστιτούτο Υγείας ΗΠΑ.
- Kogel, J. Ε. (2006). Βιομηχανικά Ορυκτά και Βράχοι: Εμπορεύματα, Αγορές και Χρήσεις 7η έκδοση. Littleton Colorado: κοινωνία εξόρυξης, μεταλλουργίας και εξερεύνησης inc.
- Εθνικό Κέντρο Βιοτεχνολογικών Πληροφοριών. (s.f.). Δημοσιευμένη βάση δεδομένων PubChem. CID = 25408. Ανακτήθηκε από το pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Τμήμα Υγείας του New Jersey. (2009, Νοέμβριος). hazartdous ουσία fact sheet διχρωμικό νάτριο. Ανακτήθηκε από nj.gov: nj.gov.
- Διχρωμικό νάτριο. Το δομικό στοιχείο για όλες σχεδόν τις άλλες ενώσεις χρωμίου. (2010-2012). Ανακτήθηκε από elementis chromium: elementischromium.com
- Κ. Ahluwalia, R. Α. (2004). Ολοκληρωμένη Πρακτική Οργανική Χημεία: Παρασκευές και Ποσοτικές Αναλύσεις. Δελχί: Πανεπιστημιακός Τύπος (Ινδία).


