Ατομικό μοντέλο των Dalton Postulates
Το Το ατομικό μοντέλο του Dalton ή Η ατομική θεωρία του Dalton, Ήταν μια πρόταση που παρουσιάστηκε μεταξύ του 1803 και του 1807 από τον Άγγλο χημικό και μαθηματικό John Dalton. Αυτή ήταν η πρώτη πρόταση εννοιολογικής οργάνωσης σχετικά με τη δομή και τη λειτουργία των ατόμων.
Το μοντέλο Dalton είναι επίσης γνωστό ως σφαιρικό μοντέλο, καθώς προτείνει το γεγονός ότι το άτομο είναι μια αδιαίρετη, συμπαγής και συμπαγής σφαίρα. Χάρη σε αυτό το μοντέλο ήταν πολύ πιο απλό να δώσει μια εξήγηση των χημικών στον κόσμο και ήταν η βάση πολλών καινοτόμων ερευνητικών έργων που ακολούθησαν. Θα μπορούσε να εξηγήσει γιατί ουσίες που αντέδρασαν σε ορισμένες πολιτείες.
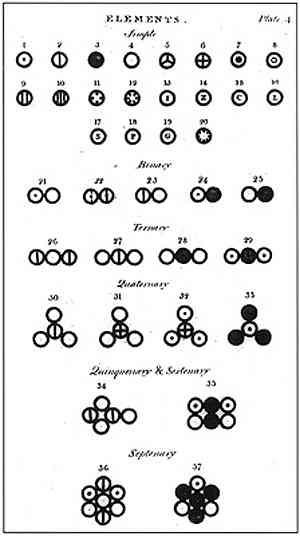
Σύμφωνα με τον Dalton, η ύλη αποτελούταν από μια ελάχιστη μονάδα που ονομάζεται άτομο, η οποία δεν μπορούσε να καταστραφεί ή να χωριστεί με οποιονδήποτε τρόπο. Αυτή η μονάδα, που προηγουμένως προτάθηκε από τον Δημόκριτο και τον σύμβουλό του Leucipo, ήταν η βάση της έρευνας του Dalton και η δημιουργία του ατομικού του μοντέλου.
Με αυτή την ατομική θεωρία, John Dalton αποδείχθηκε να επαναλάβει τις ιδέες των Ελλήνων φιλοσόφων για την ύπαρξη του ατόμου (ατομική θεωρία του σύμπαντος), αλλά χρησιμοποιώντας ως πλατφόρμα διάφορα εργαστηριακά πειράματα που θα της επέτρεπαν να αποδείξει τις ιδέες του.
Ευρετήριο
- 1 Τα αξιώματα του ατομικού μοντέλου Dalton
- 1.1 Υπόθεση 1
- 1.2 Υπόθεση 2
- 1.3 Υπόθεση 3
- 1.4 Υπόθεση 4
- 1.5 Υποψήφιος 5
- 1.6 Υποψήφιος 6
- 2 Σφάλματα του ατομικού μοντέλου του Dalton
- 2.1 Τύπος νερού
- 2.2 Σύνθεση ατόμων
- 3 Συμπεράσματα
- 4 Οι βασικές συνεισφορές του Dalton
- 4.1 Πρόδρομος ατομικών θεωριών
- 4.2 Έθεσε τα θεμέλια της σύγχρονης χημείας
- 4.3 Πρώτα να δημοσιεύσει πίνακα χημικών βαρών
- 4.4 Δώστε το όνομα στην τύφλωση χρώματος
- 5 Άρθρα ενδιαφέροντος
- 6 Αναφορές
Τα αξιώματα του ατομικού μοντέλου Dalton
Ο Dalton διατύπωσε το ατομικό του μοντέλο με 6 αξιώματα στα οποία εξηγεί πώς στήριζε τις σπουδές του και πώς τις διεξήγαγε.
Υποθέστε 1

Στην παραπάνω εικόνα παρουσιάζεται μια περίληψη του μοντέλου του Dalton: τα άτομα θα είναι μικροσκοπικές σφαίρες αδιαίρετες, άφθαρτες και ομοιογενείς.
Το πρώτο postulate του Dalton ανέφερε ότι τα στοιχεία αποτελούνται από μικροσκοπικά σωματίδια που ονομάζονται άτομα, τα οποία δεν μπορούν να χωριστούν ούτε μπορούν να καταστραφούν.
Επίσης, ο Dalton σχολίασε ότι αυτά τα σωματίδια δεν μπορούσαν να αλλάξουν σε καμία χημική αντίδραση.
Υπόθεση 2

Ο δεύτερος αξιωματικός του Dalton απέδειξε ότι όλα τα άτομα που υπάρχουν σε ένα ίδιο στοιχείο είναι ίσα σε βάρος όπως σε άλλα χαρακτηριστικά.
Από την άλλη πλευρά, διαπιστώνει επίσης ότι τα άτομα διαφορετικών στοιχείων έχουν διαφορετική μάζα. Από την πρόταση προέκυψαν οι γνώσεις των σχετικών ατομικών βαρών που αποδείχθηκαν κατά τη σύγκριση διαφόρων στοιχείων με το υδρογόνο.
Υπόθεση 3

Ο τρίτος αξιωματικός του Dalton κατέδειξε ότι τα άτομα είναι αδιαίρετα ακόμη και όταν συνδυάζονται σε χημικές αντιδράσεις. Ούτε μπορούν να δημιουργηθούν ή να καταστραφούν.
Ο συνδυασμός ατόμων, τόσο ίσων όσο και διαφορετικών, θα δημιουργήσει πιο σύνθετες ενώσεις, αλλά αυτή η διαδικασία δεν θα αλλάξει το γεγονός ότι το άτομο είναι η ελάχιστη μονάδα ύλης.
Υπόθεση 4
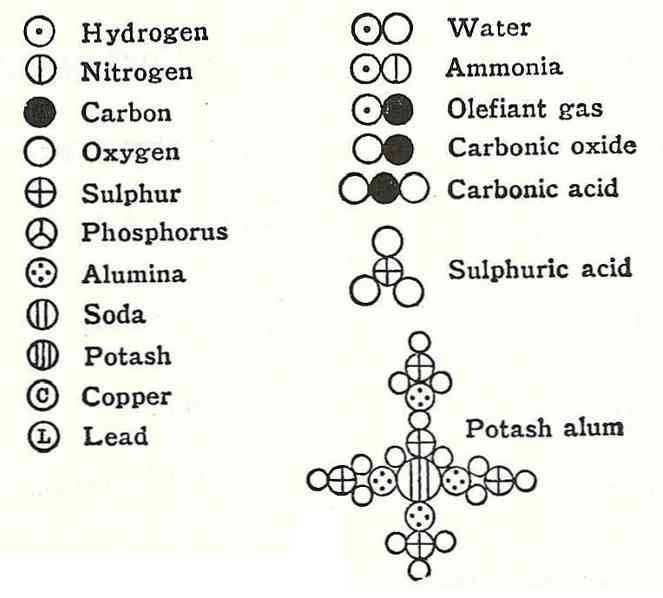
Ο τέταρτος αξιωματικός του Dalton έδειξε ότι ακόμη και όταν τα άτομα συνδυάζονται για να σχηματίσουν μια ένωση, θα έχουν πάντα μια σχέση που μπορεί να εκφραστεί με απλούς και πλήρεις αριθμούς. Αυτή η έκφραση δεν θα εμφανίζεται σε κλάσματα, αφού τα άτομα είναι αδιαίρετα.
Υπόθεση 5
Ο πέμπτος αξιωματικός του Dalton δήλωσε ότι υπάρχει ένας πιθανός συνδυασμός διαφορετικών ατόμων σε διαφορετικές αναλογίες για να σχηματίσουν περισσότερες από μία ενώσεις.
Με αυτό τον τρόπο θα μπορούσε να εξηγηθεί ότι από μια πεπερασμένη ποσότητα ατόμων έχει έρθει όλη η υπάρχουσα ύλη στο σύμπαν.
Υπόθεση 6
Το έκτο και τελικό αξίωμα του Dalton ανέφερε ότι κάθε χημική ένωση δημιουργήθηκε από το συνδυασμό των ατόμων δύο ή περισσότερων διαφορετικών στοιχείων.
Σφάλματα του ατομικού μοντέλου Dalton
Όπως όλες οι θεωρίες στον κόσμο της επιστήμης, υπήρξαν πολλές αντιδράσεις σε σχέση με το πρότυπο που πρότεινε ο Dalton, οι οποίες αποδείχθηκαν με τα χρόνια αφήνοντας πίσω τις καινοτόμες ιδέες του Dalton.
Τύπος νερού
Ένα παράδειγμα αυτού ήταν το επιχείρημα που έδωσε ο Dalton σχετικά με τον τύπο του νερού, το οποίο είπε ότι αποτελείται από υδρογόνο και οξυγόνο.
Λόγω αυτής της δήλωσης υπήρξαν πολλά λάθη υπολογισμού όσον αφορά τη μάζα και το βάρος ορισμένων βασικών ενώσεων που βασίστηκαν σε αυτές τις πληροφορίες.
Λίγα χρόνια αργότερα, οι ευρωπαίοι επιστήμονες Gay-Lussac και Alexander von Humbodt διαψεύστηκαν αυτές τις πληροφορίες και απέδειξαν ότι το νερό αποτελείται στην πραγματικότητα από δύο υδρογόνα και ένα οξυγόνο. 6 χρόνια αργότερα, ο Amadeo Avogadro επεσήμανε την ακριβή σύνθεση του νερού και λόγω αυτού υπάρχει ο νόμος Avogadro.
Σύνθεση ατόμων
Από την άλλη πλευρά, στον εικοστό αιώνα αποκαλύφθηκε η πραγματική σύνθεση των ατόμων. Στην περίπτωση αυτή αποδείχθηκε ότι υπάρχει μια μικρότερη μονάδα όπως τα πρωτόνια, τα ηλεκτρόνια και τα νετρόνια.
Ομοίως, προέκυψε η ύπαρξη των διαφορετικών ατομικών βαρών που καθορίστηκαν στον περιοδικό πίνακα των Mendeleev και Meyer, η ύπαρξη ισοτόπων και οι πιο συγκεκριμένες χημικές ιδιότητες.
Συμπεράσματα
Παρά τα λάθη της, οι συνεισφορές του Τζον Ντάλτον ήταν μεγάλη σημασία στον κόσμο της επιστήμης και προκάλεσε σάλο κατά τη στιγμή λόγω της μεγάλης ποσότητας των πληροφοριών που παρέχονται.
Οι επιστημονικές σας συνεισφορές εξακολουθούν να ισχύουν και εξακολουθούν να μελετώνται.
Το ατομικό μοντέλο του Dalton δεν αμφισβητήθηκε εδώ και δεκαετίες λόγω της σχέσης του στον κόσμο της επιστήμης και της ορθής εξήγησής του στις έρευνες και τις υποθέσεις που παρουσιάστηκαν εκείνη τη στιγμή στην ιστορία της επιστήμης.
Οι κύριες συμβολές του Dalton
Η συμβολή του στον κόσμο της επιστήμης ήταν κυρίως να αποσαφηνίσει και να διατυπώσει υποθέσεις για τη φύση μέσω ποσοτικών δοκιμών.
Ο επιστήμονας πέθανε από καρδιακό επεισόδιο στις 27 Ιουλίου 1884 στο Μάντσεστερ και λίγο αργότερα έλαβε τιμητικές διακρίσεις από τη μοναρχία.
Πρόδρομος των ατομικών θεωριών
Ο John Dalton ήταν χημικός, μαθηματικός και φυσιοδίφης. Γεννήθηκε στις 6 του Σεπτεμβρίου 1766 στο Cumberland, το Ηνωμένο Βασίλειο, και είναι γνωστή ως ένας από τους προδρόμους των ατομικών θεωριών από τη στιγμή που ο ίδιος παρουσίασε ατομικό μοντέλο του.
Έθεσε τα θεμέλια της σύγχρονης χημείας
Ο Dalton είναι γνωστός ως ένας από τους πρόδρομους για τη δημιουργία ενός πίνακα σχετικών βαρών για χημικά στοιχεία. Το γεγονός αυτό βοήθησε να τεθούν τα θεμέλια αυτού που γνωρίζουμε σήμερα ως σύγχρονη χημεία.
Πρώτα να δημοσιεύσετε ένα πίνακα χημικών βαρών
Dalton ήταν ο πρώτος επιστήμονας είχε την τιμή να δημοσιεύσει πίνακα των ατομικών βαρών όπου περιλαμβάνονται στοιχεία όπως υδρογόνο, οξυγόνο, φώσφορο, άνθρακα και θείο. Χάρη σε αυτή την έκδοση Dalton άρχισε να εργάζεται και διαμορφώνοντας το τι θα ατομικό μοντέλο του.
Δώστε το όνομα στην τύφλωση χρώματος
Θα πρέπει να σημειωθεί ότι Dalton ήταν ένας από τους πρώτους ανθρώπους που έχουν εγγραφεί με οπτικά προβλήματα για να συλλάβει τα χρώματα και λόγω αυτού ο όρος αυτός ονομάζεται ως τύφλωση χρώματος.
Άρθρα ενδιαφέροντος
Ατομικό μοντέλο του Schrödinger.
Ατομικό μοντέλο του Broglie.
Ατομικό μοντέλο του Chadwick.
Ατομικό μοντέλο του Heisenberg.
Ατομικό μοντέλο Perrin.
Ατομικό μοντέλο της Thomson.
Ατομικό μοντέλο του Dirac Ιορδανία.
Ατομικό μοντέλο του Δημόκριτου.
Ατομικό μοντέλο του Bohr.
Αναφορές
- Η ατομική θεωρία του Dalton. Ανακτήθηκε στις 24 Νοεμβρίου 2017, από το Khanacademy: www.khanacademy.org
- Η ατομική θεωρία του Dalton. Ανακτήθηκε στις 24 Νοεμβρίου 2017, από το Indiana University Northwest: iun.edu
- Ατομική θεωρία. Ανακτήθηκε στις 24 Νοεμβρίου 2017, από Encyclopædia Britannica: www.britannica.com
- Ατομική Θεωρία. Ανακτήθηκε στις 24 Νοεμβρίου 2017, από τη Βικιπαίδεια: en.wikipedia.org
- Ιστορία της Ατομικής Δομής. Ανακτήθηκε στις 24 Νοεμβρίου 2017, από τον Lumen: courses.lumenlearning.com.


